Soluzione saturata con H2S e precipitazione selettiva di due solfuri
Esercizio riguardante una soluzione saturata con H2S e precipitazione selettiva di due solfuri
Una soluzione 0,010 mol/L in Ni2+ e 0,010 mol/L in Co2+ viene saturata con H2S gassoso.
Determinare quale solfuro precipita per primo e a quale pH.
Stabilire inoltre se è possibile precipitare selettivamente i due solfuri, cioè separare i due ioni in maniera quantitativa con una precipitazione controllata dei loro solfuri.
Kps(NiS) = 1,0 · 10-22;
Kps(CoS) = 5,0 · 10-22;
Ka (H2S) = Ka1 · Ka2 = 1,1 · 10-20.
La concentrazione di H2S nella soluzione satura è considerata costante ed uguale a 0,10 mol/L.
Svolgimento dell'esercizio
Essendo Kps(NiS) < Kps(CoS) ed essendo uguali le concentrazioni iniziali degli ioni Ni2+ e Co2+, NiS precipita per primo.
Inoltre NiS inizia a precipitare quando la concentrazione dello ione solfuro è:
Kps = [Ni2+] · [S2−] = 0,010 · [S2−] = 1,0 · 10-22
Da cui:
[S2−] = 1,0 · 10-20 mol/L
La concentrazione dello ione S2− dipende da quella di H+ secondo la seguente equazione:
![]()
La concentrazione di H2S è mantenuta costante ed uguale a 0,10 mol/L facendo gorgogliare H2S nella soluzione.
Per avere la precipitazione di NiS, la concentrazione dello ione solfuro S2− deve essere 1,0 · 10-20 mol/L. In queste condizioni la [H+] è:
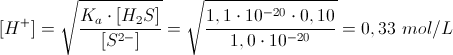
Da cui:
pH = 0,48
Quindi NiS inizia a precipitare a pH = 0,48.
Si veda ora se tutto Ni2+ precipita come solfuro prima che inizi la precipitazione di CoS. Quest'ultimo composto inizia a precipitare quando la concentrazione dello ione solfuro è uguale a:
[S2−] = (5,0 · 10-22) / (1,0 · 10-2) = 5,0 · 10-20 mol/L
ma per questa concentrazione dello ione S2− resta ancora in soluzione una concentrazione di ioni Ni2+ pari a:
[Ni2+] = (1,0 · 10-22) / (5,0 · 10-20) = 2,0 · 10-3 mol/L
che è il 20% di quella iniziale.
Quindi non è possibile separare quantitativamente i due ioni per precipitazione selettiva dei loro solfuri.
Link correlati:
Calcolo del pH di una soluzione satura di Co(OH)2
Tabella dei prodotti di solubilità (Kps)
Studia con noi