Esercizi sull'atomo
Esercizi online e gratuiti sull'atomo, sul numero di protoni, elettroni e neutroni
Riassumiamo in breve le caratteristiche principali di un atomo. Rimandiamo alle singole sezioni per un approfondimento.
L'atomo è la più piccola parte di un elemento chimico che, rispetto all'elemento conserva le proprietà chimiche ma non quelle fisiche.
È formato da elettroni che si muovono attorno a un nucleo composto (in uno schema molto semplificato) da protoni e neutroni.
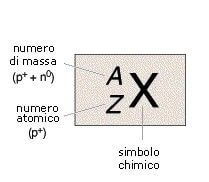
Il numero atomico (Z) di un atomo indica il numero di protoni; il numero di massa indica la somma tra neutroni e protoni.
Gli elettroni esterni al nucleo, sono numericamente uguali al numero di protoni.
Per un generico atomo X avente numero atomico Z e numero di massa A, scriveremo:
Di seguito vengono proposti alcuni esercizi riguardanti l'atomo. Gli esercizi sono svolti e commentati.
La massa degli atomi si esprime in uma - unità di massa atomica.
Chimica-online.it inoltre ti offre anche una calcolatrice scientifica.
Esercizi
1.
Qual è il numero di elettroni dell'idrogeno?
La soluzione dell'esercizio la trovi qui: quanti elettroni ha l'idrogeno.
2.
Qual è il numero di elettroni dell'alluminio?
La soluzione dell'esercizio la trovi qui: quanti elettroni ha l'alluminio.
3.
Quanti elettroni ha l'ossigeno?
La soluzione dell'esercizio la trovi qui: qual è il numero di elettroni dell'ossigeno.
4.
Il nucleo di un atomo è formato da 9 protoni e 10 neutroni. Qual è il numero di elettroni?
Lo svolgimento dell'esercizio lo trovi qui: calcolo del numero di elettroni conoscendo il numero di protoni e di neutroni.
5.
Qual è il numero di protoni, neutroni ed elettroni di 40Ar
Lo svolgimento dell'esercizio lo trovi qui: numero di protoni, neutroni ed elettroni di 40Ar.
6.
Quanti protoni, elettroni e neutroni sono contenuti in ciascuno dei seguenti isotopi?
a) 40Ca
b) 55Mn
c) 11B
d) 90Sr
La soluzione dell'esercizio la trovi qui: come calcolare il numero di protoni, elettroni e neutroni contenuti in un isotopo.
7.
Qual è il numero di protoni e quale il numero di neutroni di 32S?
La soluzione dell'esercizio la trovi qui: numero di protoni e di neutroni di 32S.
8.
Quanti protoni, elettroni e neutroni sono contenuti in ciascuno dei seguenti ioni?
a) 35Cl−
b) 85Rb+
c) 27Al3+
d) 16O2−
La soluzione dell'esercizio la trovi qui: come calcolare il numero di protoni, elettroni e neutroni contenuti in uno ione.
9.
Calcola la massa assoluta in grammi dell'acido H2SO4.
La soluzione dell'esercizio la trovi qui: come calcolare la massa assoluta.
10.
Completa la seguente tabella.
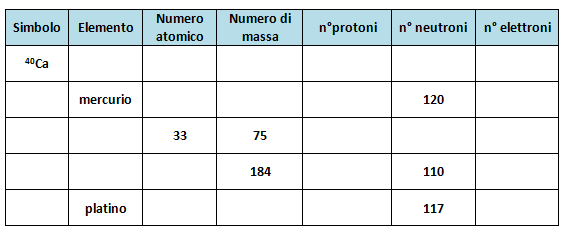
Se ti rimane più comodo puoi scaricare la tabella e stamparla.
La soluzione dell'esercizio la trovi qui: calcolo del numero di protoni, elettroni e neutroni di un nuclide.
11.
Determina la massa atomica del cloro sapendo che il cloro naturale è costituito da due isotopi con le seguenti caratteristiche:
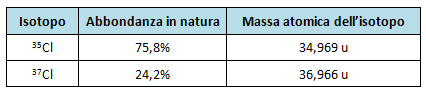
La soluzione dell'esercizio la trovi qui: massa atomica ed abbondanza isotopica.
12.
Determina la massa atomica del potassio sapendo che il potassio naturale è costituito dai seguenti tre isotopi:
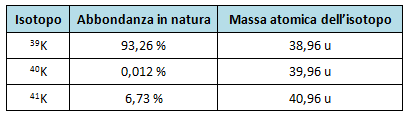
La soluzione dell'esercizio la trovi qui: esercizio sulla massa atomica del potassio.
13.
Il bromo naturale, (MA = 79,904 u) è formato da due isotopi le cui masse sono rispettivamente 78,92 u e 80,92 u. Qual è l'abbondanza % dei due isotopi?
La soluzione dell'esercizio la trovi qui: abbondanza percentuale dei due isotopi del bromo.
14.
Il carbonio naturale (MA = 12,011 u) è costituito da due isotopi.
Uno dei due isotopi ha una abbondanza percentuale del 98,90 % e una massa di 12,00 u.
Determinare la massa del secondo isotopo.
La soluzione dell'esercizio la trovi qui: massa di uno dei due isotopi del carbonio.
Studia con noi