Sostituzione nucleofila di secondo ordine
Sostituzione nucleofila bimolecolare SN2
I meccanismi SN1 e SN2 differiscono fra loro per i relativi tempi di formazione del legame nuovo e rottura del legame vecchio.
Una sostituzione SN2 presenta le seguenti caratteristiche:
- la reazione è concertata nel senso che la formazione e la rottura del legame avvengono contemporaneamente; il meccanismo della reazione prevede pertanto un unico stadio che coinvolge entrambe le molecole reagenti (A-Lg e Nu);
- la cinetica della reazione è del secondo ordine; la velocità di reazione può essere infatti accellerata aumentando la concentrazione di uno solo dei due reagenti o di entrambi.
La legge cinetica di tale reazione è dunque del tipo: v = k · [R-Lg] · [Nu]
- il carbonio al quale avviene la sostituzione cambia la sua ibridazione da sp3, come era nel prodotto di partenza, a sp2, come è nello stato di transizione;
- nello stato di transizione il gruppo entrante (Nu) e il gruppo uscente (Lg) contemporaneamente si sovrappongono da parti opposte all'orbitale p, che è perpendicolare al piano che contiene gli altri tre residui legati al carbonio;
- il carbonio a cui si verifica la sostituzione subisce una inversione di configurazione (inversione di Walden).
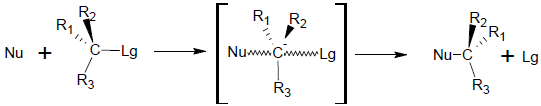
In cui:
Nu = nucleofilo
Lg = leaving group (gruppo uscente)
Un esempio di reazione che procede attraverso un meccanismo di sostituzione nucleofila SN2 è il seguente:
Br− + CH3I → CH3Br + I−
Il diagramma di energia per questa reazione è il seguente:
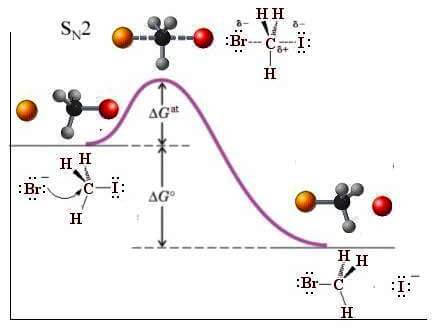
Si noti che lo stato di transizione (massimo di energia) prevede una geometria bipiramidale trigonale nella quale il gruppo entrante (Br−) e il gruppo uscente (I−) si sovrappongono contemporaneamente e da parti opposte all'orbitale p, che è perpendicolare al piano che contiene i tre atomi di idrogeno. Si noti anche che il carbonio a cui si verifica sostituzione subisce inversione di configurazione.
Ordine di reattività nelle reazioni SN2
Si è trovato sperimentalmente che la sostituzione nucleofila SN2 dipende in modo sensibile dalla struttura dell'alogenuro alchilico, dato che il nucleofilo entrante deve farsi largo verso l'atomo di carbonio dalla parte opposta a quella che porta l'alogeno uscente, e se sono legati al carbonio stesso dei gruppi ingombranti questi ostacoleranno l'entrata del nucleofilo.
Questo fenomeno si chiama impedimento sterico alla reazione SN2. La reazione SN2 è quindi favorita su atomi di carbonio meno sostituiti (cioè con più atomi di idrogeno legati).
L'ordine della reattività SN2 è quindi:
metilico > primario > secondario > terziario
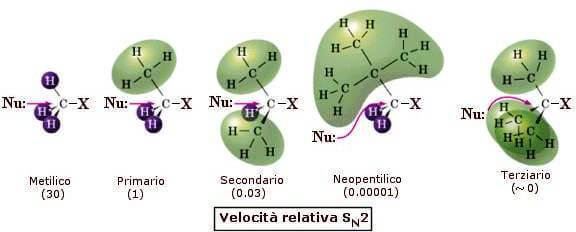
Gli alogenuri di metile sono quindi i più veloci nelle sostituzioni SN2 perché hanno solo tre atomi di idrogeno proiettati contro il nucleofilo entrante. Anche gli alogenuri alchilici primari reagiscono velocemente poiché un'unica catena lineare attaccata al carbonio a cui avviene l'inversione può disporsi in modo da non dare interazioni sensibili. L'impedimento sterico all'attacco del nucleofilo è maggiore negli alogenuri secondari ma la reazione può verificarsi ugualmente a una velocità apprezzabile. Con gli alogenuri terziari l'impedimento sterico diviene pressoché proibitivo.
Natura del nucleofilo
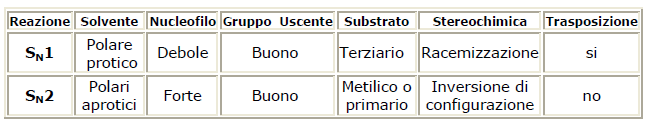
Anche la natura del nucleofilo influenza la reazione SN2. La SN2 richiede nucleofili forti e per favorire l'attacco elettrofilo si predilige l'uso di solventi polari aprotici (cioè che non liberano ioni H+). Anche la natura del gruppo uscente influenza la reazione SN2. Un Lg troppo buono tende infatti ad uscire ancor prima dell'attacco del nucleofilo favorendo una reazione SN1; la reazione SN2 è pertanto favorita da Lg deboli.
Riassumento, una reazione SN2 è favorita da:
- gruppi Lg deboli (Lg = leaving group = gruppo uscente)
- forti nucleofili;
- alogenuri alchilici primari o secondari.
Studia con noi