Eteri corona o crown eteri
Polieteri ciclici ad anello grande: gli eteri corona
Gli eteri corona (o crown eteri) sono polieteri ciclici ad anello grande al cui interno si ripete l'unità -CH2-CH2-O-.
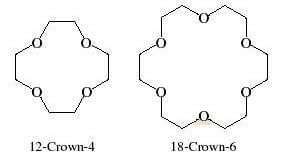
Il termine più piccolo contiene 4 atomi di ossigeno in un anello di 12 atomi totali.
Nomenclatura degli eteri corona
La nomenclatura degli eteri corona avviene utilizzando il termine "crown" seguito dal numero di atomi di ossigeno e preceduto dal numero di atomi totali presenti nell'anello.
Pertanto:
Proprietà
La caratteristica principale degli eteri corona è che hanno una notevole abilità a solubilizzare i sali dei metalli alcalini nei solventi organici non polari.
Questi eteri corona formano infatti dei complessi specifici con i cationi dei metalli alcalini; la specificità per un dato catione è legata alla dimensione della "cavità" al centro dell'etere corona e alla presenza di doppietti elettronici non condivisi sull'ossigeno che permette agli eteri di comportarsi come basi di Lewis nei confronti del catione metallico (acido di Lewis).
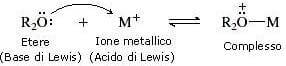
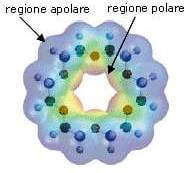
Presentando, all'interno della cavità, numerosi atomi di ossigeno, gli eteri corona formano complessi molto stabili con i cationi metallici.
La parte interna dell'etere corona (regione polare) segrega quindi il catione metallico.
A causa della presenza dei gruppi -CH2-, la regione esterna all'anello è apolare e garantisce la solubilità nel solvente apolare dell'etere corona che ha segregato il catione metallico al suo interno.
È per tale motivo che gli eteri corona riescono a solubilizzare i sali dei metalli alcalini nei solventi organici non polari.
Se ad esempio aggiungiamo del KF (fluoruro di potassio) ad una soluzione di 18-crown-6 in benzene, lo ione K+ viene segregato all'interno dell'etere corona formando un complesso molto stabile.
La cavità del 18-crown-6 presenta un diametro tale da poter ospitare lo ione potassio.
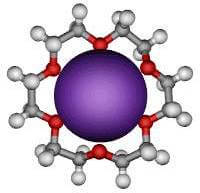
La complessazione di ogni singolo ione potassio fa sì che ci sia uno ione fluoruro F− non solvatato.
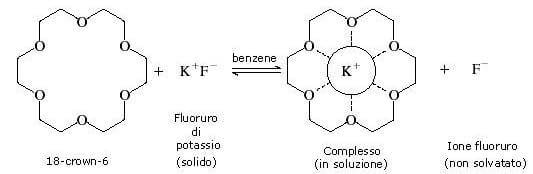
Tale ione fluoruro rimasto senza la sua "controparte ionica" risulta, in un solvente organico non polare, estremamente reattivo. Così esso diviene un nucleofilo estremamente efficiente, capace di convertire in fluoruri i normali alogenuri alchilici.

Attraverso vie alternative, i fluoruri alchilici sarebbero difficilmente ottenibili.
Studia con noi