Ammine
Generalità e proprietà delle ammine
Le ammine possono essere considerate derivati organici dell'ammoniaca nella quale, uno, due o tutti e tre gli atomi di idrogeno sono sostituiti con residui alchilici o arilici.
In base al tipo di residuo legato all'atomo di azoto, le ammine possono essere classificate come:
ammine alifatiche: se i residui sono unicamente di tipo alifatico
ammine aromatiche: se almeno uno dei residui è di tipo aromatico
ammine eterocicliche: se l'atomo di azoto fa parte di un ciclo aromatico o alifatico
In base al numero di atomi di idrogeno sostituiti, le ammine possono essere invece classificate in ammine primarie, ammine secondarie e ammine terziarie:
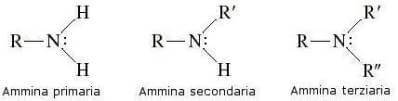
In una ammina l'atomo di azoto presenta ibridazione sp3 e geometria piramidale:
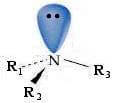
In base a questa geometria, per una ammina terziaria con gruppi diversi legati all'atomo di azoto, si potrebbe supporre che presenti chiralità ed essere separabile nei rispettivi enantiomeri.
In realtà, le ammine di questo tipo non manifestano attività ottica in quanto i due enantiomeri si interconvertono, anche a basse temperature, molto rapidamente attraverso un movimento simile a quello di un ombrello che si rovescia per un colpo di vento:
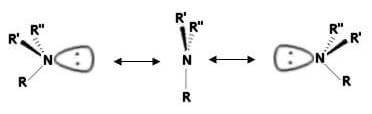
Lo stato di transizione presenta geometria trigonale planare.
Basicità delle ammine
Le ammine (così come l'ammoniaca) sono sostanze che in acqua presentano un debole carattere basico. Grazie al doppietto solitario sull'atomo di azoto, ogni ammina può strappare un protone all'acqua e trasformarsi nel suo acido coniugato (R3NH+):
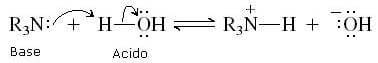
La costante di basicità per questa reazione vale:

La basicità delle ammine dipende sensibilmente dai sostituenti legati all'atomo di azoto. Le alchilammine (R—NH2) ad esempio sono più basiche dell'ammoniaca: in particolare la metilammina (CH3—NH2) è circa 22 volte più basica dell'ammoniaca.
Il gruppo metilico della metilammina è infatti un gruppo elettron-repulsore e per effetto induttivo stabilizza la carica positiva presente sull'acido coniugato (R3NH+) e sposta l'equilibrio precedente verso destra.
Le ammine secondarie sono leggermente più basiche delle ammine primarie, mentre per le ammine terziarie c'è un'inversione di tendenza e sono pertanto meno basiche delle ammine secondarie. Il motivo di questo comportamento è da ricercarsi nell'ingombro sterico dei tre sostituenti che, tra l'altro, diminuisce anche l'effetto di solvatazione dell'acqua sullo ione alchilammonio (R3NH+), rendendolo meno stabile.
Le ammine aromatiche invece sono basi molto più deboli delle ammine alifatiche. L'anilina ad esempio presenta una basicità che è un milione di volte inferiore a quella della cicloesilammina.
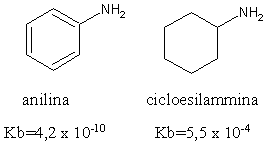
Ciò è dovuto alla delocalizzazione per risonanza del doppietto elettronico presente sull'atomo di azoto dell'anilina:
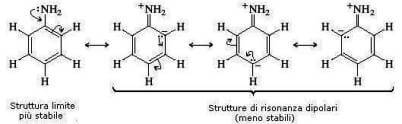
La densità elettronica sull'atomo di azoto diminuisce e con essa la sua basicità (si veda teoria di lewis). Questo succede per l'anilina ma non per la cicloesilammina.
Proprietà fisiche delle ammine: solubilità e legami a idrogeno
Le ammine hanno punti di ebollizione intermedi tra quelli degli alcani e quelli degli alcoli (di massa molecolare simile).
Infatti i legami a idrogeno N—H---N intermolecolari, sebbene siano di notevole intensità e facciano in modo che i punti di ebollizione delle ammine siano superiori a quelli degli alcani di massa molecolare simile, sono meno forti dei legami a idrogeno O—H---O degli alcoli.
Ciò è dovuto al fatto che l'azoto è meno elettronegativo dell'ossigeno.
Le ammine possono formare legami a idrogeno con l'acqua; per questo motivo le ammine contenenti sino a sei atomi di carbonio sono molto solubili in acqua.
Alcuni farmaci come ad esempio la benzedrina (appartenente alla categoria delle amfetamine) sono delle ammine.
Nomenclatura delle ammine
Per la nomenclatura delle ammine si veda: regole IUPAC per la nomenclatura delle ammine.
Esercizi sulle ammine
Li trovi al seguente link: esercizi sulle ammine.
Studia con noi