Allene
Struttura dell'allene ed enantiomeri degli alleni sostituiti
Il composto base della serie dei dieni coniugati è l'allene (1,2-propadiene) CH2=C=CH2.
Nell'allene i due doppi legami e quindi i due gruppi metilenici terminali si trovano sue due piani differenti che formano l'un l'altro un angolo di 90°:
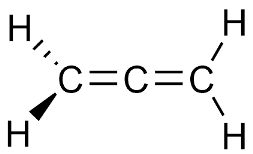
Una rappresentazione degli orbitali atomici può rendere conto della ragione di una tale sistemazione. Consideriamo dapprima il sistema di legami σ.
Ciascuno dei due atomi di carbonio terminali è legato ad altri tre atomi (due di idrogeno e uno di carbonio) e quindi ha una ibridazione sp2.
L'atomo centrale, che è legato (con doppi legami) agli altri due atomi di carbonio, ha una ibridazione sp.
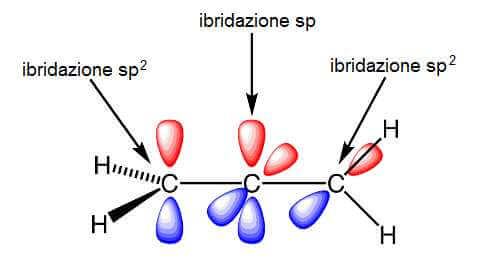
L'atomo di carbonio centrale ha quindi ancora a disposizione due orbitali p (2py e 2pz) per formare due legami π.
Uno di questi due può sovrapporsi all'orbitale 2py di uno dei due metileni per formare un legame π e l'altro si sovrappone all'orbitale 2pz dell'altro gruppo metilenico, in un piano perpendicolare al primo (infatti gli orbitali 2py e 2pz sono perpendicolari tra loro).
Enantiomeri degli alleni sotituiti
La geometria degli alleni ha come conseguenza che qualunque allene che abbia una sostituzione del tipo abC=C=Cba deve esistere in due forme enantionere e deve mostrare attività ottica.
Di seguito vengono rappresentati i due enantiomeri del generico allene abC=C=Cba usando sia le formule prospettiche che quelle di proiezione:
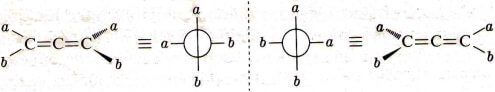
Enantiomeri degli alleni sostituiti abC=C=Cba
Se uno dei due atomi di carbonio terminali ha due sostituenti identici (per esempio aaC=C=Cbc) gli enantiomeri non sono più possibili perché la molecola possiede un piano di simmetria.
La stereoisomeria cis-trans non esiste per i composti allenici.
Studia con noi