Alchilazione degli alcani
Processo di alchilazione degli alcani
L'alchilazione è un processo grazie al quale alcani ed alcheni a basso peso molecolare possono combinarsi tra loro per formare alcani più grossi e altamente ramificati, da usarsi nelle benzine.
L'alchilazione rappresenta un processo molto importante per l'industria petrolifera.
In questa maniera, infatti, gli idrocarburi a basso peso molecolare ottenuti dai processi di cracking vengono convertiti in alcani a peso molecolare medio, altamente ramificati, che vengono chiamati idrocarburi alchilati e che servono a migliorare il numero di ottano delle benzine.
Ad esempio, l'isobutano ottenuto dal n-butano per isomerizzazione viene usato per preparare il 2,2,4-trimetilpentano (lo standard che ha numero di ottano uguale a 100).
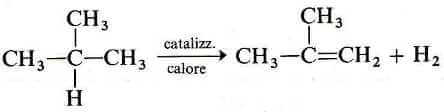
Dapprima si converte l'isobutano in isobutene, scaldandolo ad alta temperatura su di un addotto catalizzatore. Dalla reazione viene eliminato idrogeno gassoso (H2).
A bassa temperatura e in presenza di un acido forte, come l'acido solforico che funge da catalizzatore l'isobutene viene successivamente fatto reagire con l'isobutano. La reazione globale che si realizza è l'alchilazione che porta alla formazione del 2,2,4-trimetilpentano.
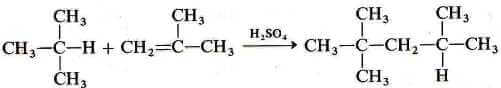
Meccanismo della reazione di alchilazione
Nell'ultimo passaggio descritto, il catalizzatore acido solforico e l'alchene generano un carbocatione, in questo caso il catione t-butilico:
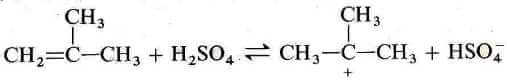
La reazione tra il catione t-butilico e un'altra molecola di alchene produce un carbocatione a otto atomi di carbonio:
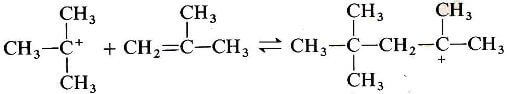
Infine si forma il 2,2,4-trimetilpentano per transfer di idruro dall'isobutano:
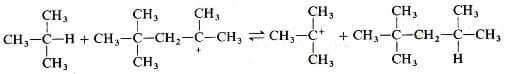
Allo scopo di favorire questo ultimo stadio ed evitare che il catione 1,1,3,3-tetrametilbutile reagisca con un'altra molecola di alchene, si usa un eccesso di isobutano. Il catione t-butilico formato nell'ultimo stadio reagisce con l'isobutene per continuare il processo a catena.
Il catione t-butilico e l'eccesso di isobutano sono anche in reazione di equilibrio fra loro ma i prodotti e i reagenti sono in questo caso identici e quindi non si osserva alcuna modificazione reale:
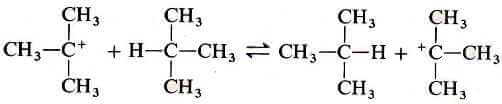
Studia con noi