Termometro a gas
Principio di funzionamento di un termometro a gas
La temperatura è una grandezza fisica fondamentale nel Sistema Internazionale, ovvero una grandezza indipendente da cui possono essere derivate tutte le altre.
Essa rappresenta il livello di energia a livello microscopico posseduto da un corpo.
In altre parole è un indice del grado medio di agitazione cinetica delle molecole di un corpo.
Lo strumento che serve a misurare la temperatura è il termometro.
Ne esistono di diversi tipi sfruttando diversi principi fisici per l'indicazione della temperatura.
Tra questi vi è il termometro a gas.
Funzionamento di un termometro a gas
Un termometro a gas è composto da un bulbo in cui è posto un gas connesso tramite un tubo a U ad un serbatoio.
In tale tubo è posto del liquido solitamente mercurio.
Quando si vuole misurare la temperatura di una sostanza, si inserisce il bulbo, contenente il gas che si trova ad una certa pressione, a contatto con la sostanza stessa.
Il gas si porterà così alla stessa temperatura del corpo di cui si vuole conoscere la temperatura.
Essendo il gas confinato nel bulbo, la trasformazione che sta avvenendo è a volume costante, cioè il gas non può espandersi ma all'aumentare della temperatura aumenterà la pressione che esercita sul contenitore e quindi sul mercurio.
Viceversa al diminuire della temperatura il valore della pressione diminuirà.
Così come già detto per la seconda legge di Gay Lussac pressione e temperatura sono direttamente proporzionali:
P / T = K
con K costante.
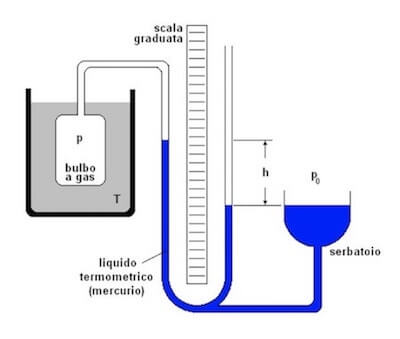
Mentre il serbatoio è posto alla pressione atmosferica, la variazione di altezza del mercurio lungo una scala graduata permette di stabilire la differenza di pressione tra il gas nel bulbo e la pressione atmosferica.
Come si può calibrare un termometro a gas?
Il principio su cui si basa un termometro a gas è quello di misurare la pressione di un gas la cui temperatura varia a seconda della temperatura del corpo da misurare, sapendo che la variazione avviene a volume costante.
Per calibrare il termometro abbiamo bisogno di conoscerne la curva caratteristica nel piano pressione – temperatura P-T.
Come sappiamo dalla seconda legge di Boyle, pressione e temperatura sono due grandezze direttamente proporzionali relativamente ad una trasformazione isocora (a volume costante).
Per cui il grafico P-T sarà una retta.
Per disegnare una retta nel piano abbiamo bisogno di due punti.
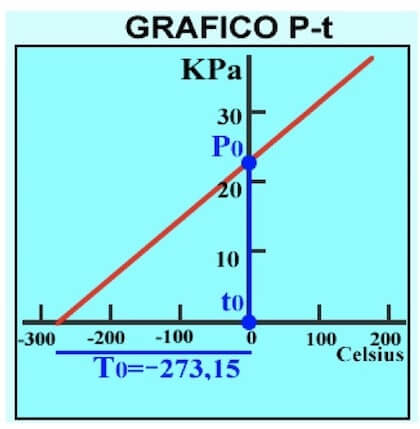
Ma un punto è già presente in quanto sappiamo che per lo zero assoluto T0 la pressione del gas è nulla:
P(-273,15°C) = 0
Per cui sarà sufficiente effettuare la calibrazione del termometro soltanto in un altro punto di temperatura nota, ad esempio mettendo a contatto il bulbo contenente il gas con del ghiaccio fondente che sappiamo trovarsi sicuramente a t0 = 0°C.
Misuriamo la pressione del nostro gas contenuto nel bulbo e rileviamo una pressione di 23 kPa.
Quindi il secondo punto da rappresentare sarà quello per cui:
P0(0) = + 23 kPa
Otteniamo il seguente grafico:
Ora supponiamo di voler misurare la temperatura di un qualsiasi altro corpo sfruttando sempre il termometro a gas appena calibrato.
Mettiamo a contatto il bulbo del termometro col nuovo corpo e rileviamo una pressione di 30 kPa.
Andiamo a tracciare il valore di 30 kPa sull'asse delle ordinate, in cui sono presenti le pressioni, e vediamo a quale ascissa corrisponde.
La temperatura di riferimento sarà 83,3°C circa :
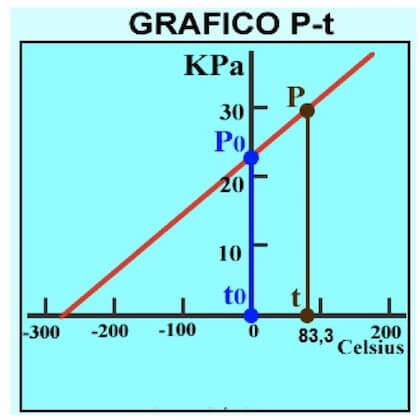
Il calcolo si può effettuare attraverso la seguente proporzione:
(0 + 273,15) : 23 = x : 30
Da cui:
x = (30 ∙ 273,15) / 23= 356,3 K
che corrispondono a:
x = (356,3 - 273) °C = 83,3°C
Ricordiamo che (in questi casi) i calcoli vanno effettuati sempre considerando la temperatura in Kelvin e mai in Celsius!
Studia con noi