Tensione interfacciale
Che cos'è la tensione interfacciale?
Consideriamo un liquido (ad esempio acqua) contenuta all'interno di un recipiente.
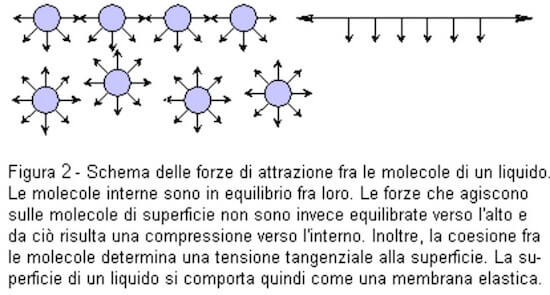
Ciascuna molecola interna alla massa del liquido, è circondata da ogni parte da altre molecole che tendono ad attrarla.
La molecola è ugualmente sollecitata in tutte le direzioni e la risultante delle sollecitazioni è nulla (si veda immagine seguente).
Nello strato superficiale, invece, si hanno molecole le cui sollecitazioni non sono ugualmente distribuite in tutte le direzioni.
Ciò succede in quanto la risultante delle forze attrattive del liquido non è compensata in superficie da quelle in fase gas.
Di conseguenza la sommatoria di tutte le sollecitazioni che agiscono su ciascuna molecola presente in superficie non è nulla ma è diretta verso l'interno del liquido.
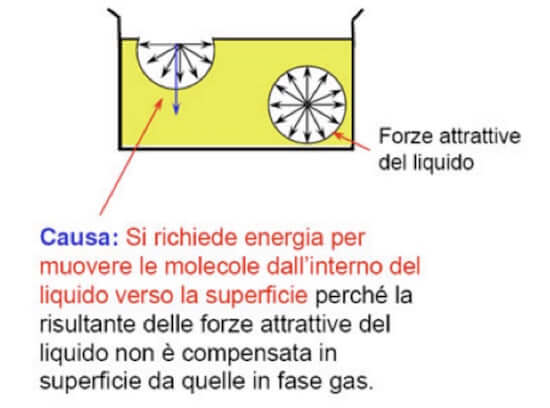
La forza superficiale di coesione tra le molecole appena descritta prende il nome di tensione superficiale.
La tensione interfacciale tra due liquidi
Se la superficie di un liquido invece di essere a contatto con una fase gassosa (come avviene nella - appena descritta - tensione superficiale) è a contatto con un altro liquido col quale non sia miscibile (ad esempio acqua e mercurio oppure acqua e benzene), non cambia concettualmente nulla di quanto si è detto perché resta fermo il fatto che le molecole dell'interfase sono soggette ad interazioni di entità diversa da parte delle due diverse fasi; in questo caso si parla di tensione interfacciale.
Se i due liquidi sono miscibili allora il valore della loro tensione interfacciale è praticamente nullo.
Studia con noi