Diluizione
Diluizione di una soluzione: formule ed esercizi
In questa lezione vedremo che cosa si intende per diluizione di una soluzione. Vedremo quali sono le formule che regolano la diluizione di una soluzione e, tramite semplici esempi numerici, vedremo come applicarle.
Prerequisito: per comprendere la diluizione bisogna avere ben chiaro che cosa è il soluto e che cosa è il solvente di una soluzione. Per soluto si intende il componente in quantità minore della soluzione che viene aggiunto al solvente che è il componente presente in quantità maggiore. Il soluto sciolto nella soluzione formano la soluzione, che altro non è che un miscuglio omogeneo nel quale i due componenti non sono più identificabili neanche con l'ausilio di un microscopio.
Che cos'è la diluizione?
La diluizione è un'operazione che comporta l'aggiunta di solvente ad una soluzione in modo tale da portare il valore della concentrazione della soluzione da un valore iniziale Mi ad un valore finale Mf inferiore di Mi.
Durante la diluizione il volume della soluzione pertanto aumenta, mentre la concentrazione della soluzione diminuisce.
Formula della diluizione
Per ricavare la formula della diluizione, bisogna pensare che durante la diluizione di una soluzione (e quindi durante l'aggiunta di solvente alla soluzione) la quantità di soluto resta invariata perciò, il numero di moli di soluto prima (ni) e dopo (nf) la diluizione resta invariato:
ni = nf
Ricordando che la molarità è pari a:
M = nsoluto / Vsoluzione
e dunque:
nsoluto = M · Vsoluzione
si ha che:
![]()
in cui:
- Mi = molarità iniziale della soluzione, prima della diluizione;
- Mf = molarità finale della soluzione, dopo la diluizione;
- Vi = volume iniziale della soluzione, prima della diluizione;
- Vf = volume finale della soluzione, dopo la diluizione.
Dalla formula precedente risulta che:
![]()
Tale formula permette il calcolo del volume finale Vf di una soluzione ottenuta ottenuta aggiungendo solvente alla soluzione di volume iniziale Vi. Supponendo i volumi additivi, il volume aggiunto di solvente è:
![]()
Alternativamente, dalla formula precedente, potremmo ricavarci:
1) la molarità iniziale Mi dividendo il prodotto tra Mf e Vf per il volume Vi:
![]()
2) il volume iniziale dividendo il prodotto tra Mf e Vf per la molarità Mi:
![]()
3) la molarità finale dividendo il prodotto tra Mi e Vi per il volume Vf:
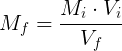
Per una generica concentrazione C, ad esempio espressa in g/L, la formula della diluizione diventa:
Ci · Vi = Cf · Vf
Ricordiamo infine che la diluizione di una soluzione liquida è quasi sempre accompagnata dallo sviluppo di una certa quantità di calore detto calore di diluizione.
Esercizio #1
A 500 mL di una soluzione 0,2 M vengono aggiunti 1,5 L di acqua. Determinare la molarità finale della soluzione considerando i volumi additivi.
Svolgimento
L'esercizio propone il calcolo della molarità finale Mi di una soluzione ottenuta aggiungendo 1,5 L di acqua a 500 mL di una soluzione 0,2 M.
Siccome i volumi possono essere considerati additivi, si ha che il volume finale della soluzione è 2 L (0,5 + 1,5 = 2L).
Dalla formula:
![]()
ricaviamo Mf:
Mf = Mi · Vi / Vf = 0,2 · 0,5 / 2 = 0,05 M
Quindi la molarità finale della soluzione è 0,05 M.
Il risultato ottenuto è anche abbastanza logico: se il volume della soluzione passa da 500 mL a 2000 mL il volume quadruplica e pertanto la molarità diventa un quarto, ovvero quattro volte più piccolo, in numeri: 0,2 : 4 = 0,05 M
Esercizio #2
A quale volume devono essere portati 200 mL di una soluzione 0,5 M per ottenere una soluzione 0,1 M.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del volume finale Vf a cui bisogna portare 200 mL di una soluzione 0,5 M per ottenere una soluzione 0,1 M.
La formula da applicare è la seguente:
Vf = Mi · Vi / Mf
in cui:
Mi = 0,5 M
Vi = 200 mL
Mf = 0,1 M
Sostituendo i dati si ha che:
Vf = 0,5 M · 200 mL / 0,1 M = 1000 mL
pertanto il volume a cui bisogna portare la soluzione è 1000 mL ovvero 1 litro.
Come hai potuto notare, malgrado la concentrazione sia espressa in mol/L, il volume è stato lasciato in mL. Tale procedimento è corretto, infatti nell'analisi dimensionale le due molarità M si semplificano e il risultato risulterà mL.
Altri esercizi
Altri esercizi svolti e commentati li trovi al seguente link: esercizi sulle soluzioni.
Quiz sulle soluzioni
Li trovi qui: quiz sulle soluzioni.
Link correlati:
Come si effettua una diluizione 1 a 10?
Esercizio svolto sulla diluizione 1 a 50
Preparazione di soluzioni standard diluite da una soluzione standard concentrata
Studia con noi