Abbassamento crioscopico
Come si calcola l'abbassamento crioscopico di una soluzione
L'abbassamento crioscopico è una delle proprietà colligative delle soluzioni; tali proprietà dipendono unicamente dal numero di particelle di soluto presenti nel solvente e non dalla loro natura chimica e fisica.
Che cos'è l'abbassamento crioscopico?
Una soluzione congela a una temperatura più bassa di quella del solvente puro: la diminuzione del punto (o temperatura) di congelamento si chiama abbassamento crioscopico.
Pertanto, si definisce abbassamento crioscopico la differenza tra la temperatura di congelamento della soluzione e la temperatura di congelamento del solvente.
Anche questa proprietà delle soluzioni, come le altre proprietà colligative, è una diretta conseguenza dell'abbassamento della tensione di vapore della soluzione rispetto a quella del solvente puro; semplificando si può dire che in soluzione, le molecole del soluto interferiscono con le forze attrattive tra le molecole del solvente ed ostacolano la solidificazione delle molecole del solvente alla loro normale temperatura di congelamento.
Pertanto la temperatura di congelamento di una soluzione si abbassa rispetto a quella del solvente puro, cioè per esempio, per l'acqua salata si presenta a una temperatura inferiore a 0 °C.
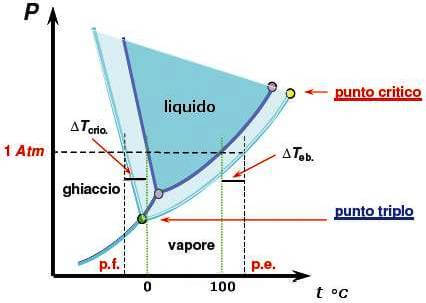
Diagramma di stato di una soluzione (in azzurro) confrontato al diagramma di stato dell'acqua (in blu). Si noti come la linea della tensione di vapore della soluzione slitti vero sinistra ed incontri l'ordinata P = 1 atm a temperature inferiori a 0°C.
Inoltre, quando una soluzione solidifica, in realtà è solo il solvente che congela "espellendo" dal reticolo solido che sta formando le particelle del soluto. In questo modo la soluzione liquida che ancora non ha congelato aumenta la propria concentrazione in soluto ed il suo punto di congelamento si abbassa ulteriormente. Questo spiega il perché le soluzioni non congelano ad una temperatura fissa ma si solidificano gradualmente in un arco di temperature più o meno ristretto.
Come calcolare l'abbassamento crioscopico
L'abbassamento della temperatura di congelamento (abbassamento crioscopico) Δtcr di una soluzione rispetto a quella del solvente puro è direttamente proporzionale alla molalità (m) della soluzione:
![]()
dove Δtcr è l'abbassamento crioscopico, uguale alla temperatura di congelamento della soluzione meno quella del solvente puro (Δtcr = tc.soluz - tc.solv) e Kcr è la costante crioscopica. Kcr varia da solvente a solvente e per l'acqua vale 1,86 (°C · kg) / mol.
Se la sostanza disciolta è dissociata in ioni, bisogna anche introdurre il coefficiente i di Van't Hoff. Esso vale 2, 3, 4, .... a seconda del numero di ioni in cui l'elettrolita è dissociato. Si ha:
![]()
Per esempio: nel caso del solfato di sodio (Na2SO4 → 2Na+ + SO42−) i = 3; nel caso dell'acido cloridrico (HCl → H+ + Cl−) i = 2.
È infine bene ricordare che se la soluzione è composta da due o più soluti non volatili, la molalità m che compare nella formula precedente, si ottiene sommando semplicemente la molalità dei singoli soluti.
La branca della chimica che studia l'abbassamento crioscopico è la crioscopia.
Costanti crioscopiche di alcune sostanze
Nella seguente tabella vengono riportate le costanti crioscopiche (Kcr) e le relative temperature di solidificazione (ts) calcolate alla pressione di 1 atm, di alcuni solventi molto comuni.
Acqua: ts = 0,00°C ; Kcr = 1,86 (°C · kg) / mol
Alcol etilico: ts = -117,3°C ; Kcr = 1,99 (°C · kg) / mol
Acido acetico: ts = 16,6°C ; Kcr = 3,90 (°C · kg) / mol
Benzene: ts = 5,5°C ; Kcr = 4,90 (°C · kg) / mol
Cicloesano: ts = 6,2°C ; Kcr = 20,2 (°C · kg) / mol
Fenolo: ts = 41°C ; Kcr = 7,40 (°C · kg) / mol
Nitrobenzene: ts = 5,7°C ; Kcr = 6,90 (°C · kg) / mol
Fluidi refrigeranti
Di largo impiego sono le soluzioni acquose di anticongelanti utilizzate come fluidi refrigeranti per motori a scoppio o come detergenti per vaschette lavavetri; tali soluzioni basano il loro funzionamento sul principio dell'abbassamento crioscopico.
È giunto ora il momento di mettere in pratica quanto detto e di svolgere un esercizio sul calcolo dell'abbassamento crioscopico.
Esercizio
Si calcoli l'abbassamento crioscopico di una soluzione acquosa ottenuta sciogliendo in 500 g di acqua 9 g NaCl (MM = 58,44 g/mol), essendo noto che per l'acqua Kcr = 1,86 (°C · kg) / mol.
Svolgimento dell'esercizio
Calcoliamo il numero di moli di soluto dividendo la massa in grammi del soluto per il valore della massa molare del soluto stesso:
n = g/MM = 9/58,44 = 0,154 mol
Calcoliamo la molalità della soluzione dividendo il numero di moli di soluto per la massa in kg del solvente:
m = n/msolv = 0,154/0,500 = 0,308 mol/kg
Calcoliamo infine l'abbassamento crioscopico:
Δtcr = i · Kcr · m
In questo caso bisogna però ricordare che il cloruro di sodio è un elettrolita, ovvero è un composto che in soluzione acquosa si dissocia in ioni, secondo la seguente equazione:
NaCl → Na + + Cl−
Essendo due gli ioni che si vengono a formare (Na + e Cl−) il coefficiente i di Van't Hoff vale 2. Pertanto:
Δtcr = i · Kcr · m = 2 · 1,86 · 0,308 = 1,15°C
Pertanto la soluzione congelerà ad una temperatura di:
tc.soluz = 0 - 1,15 = - 1,15°C
Esercizi sulle proprietà colligative
Li trovi al seguente link: esercizi sulle proprietà colligative.
Link correlati:
Esercizio svolto e commentato sull'abbassamento crioscopico
Che cos'è l'innalzamento ebullioscopico
Che cos'è il processo di dialisi?
Vuoi sapere perché il sale scioglie il ghiaccio?
Che cosa sono le miscele frigorifere?
Studia con noi