Serie elettrochimica
Che cos'è la serie elettrochimica?
La serie elettrochimica è la classificazione dei potenziali standard di riduzione di coppie in equilibrio redox.
I potenziali standard di riduzione indicano la tendenza di una coppia redox (Ox / Red) a subire il processo di riduzione:
Ox + n e− ⇄ Red
in cui:
- Ox è una generica specie ossidata;
- Red è una generica specie ridotta;
- n e− rappresentano n elettroni scambiati tra la specie ossidata e la specie ridotta.
I valori dei potenziali standard di riduzione vengono calcolati scegliendo come elettrodo di riferimento un elettrodo standard ad idrogeno a cui è attribuito convenzionalmente il potenziale zero.
La serie elettrochimica (Tab. I seguente) ordina le coppie redox partendo dal massimo valore positivo rispetto all'elettrodo di idrogeno:
F2 + 2H+ + 2e− ⇄ 2 HF ; E° = +3,03 V
fino al massimo valore negativo:
Li+ + e− ⇄ Li ; E° = -3,05 V.
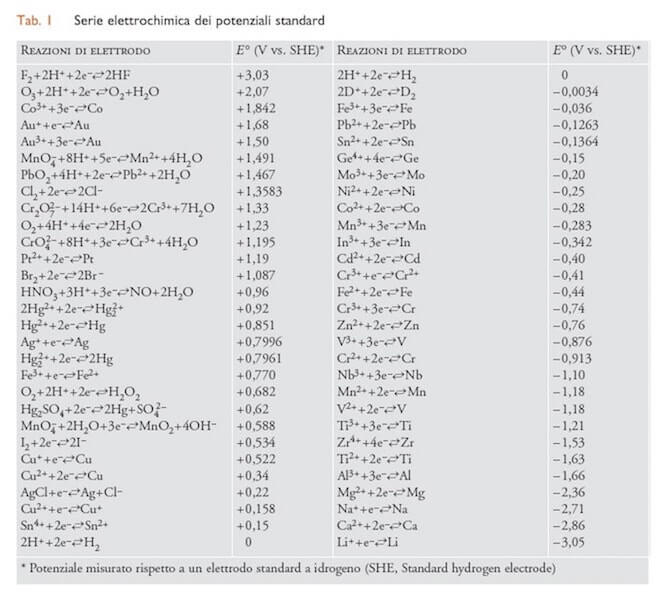
Una determinata coppia redox agisce da ossidante su quelle che nella serie elettrochimica la seguono, mentre agisce da riducente su quelle che la precedono nella serie.
Facciamo un esempio: immergendo una barretta di zinco all'interno di una soluzione contenente ioni Cu2+, è possibile notare l'ossidazione dello zinco a Zn2+ (Zn(s) → Zn2+(aq) + 2e−) e la contemporanea riduzione degli ioni Cu2+ a rame metallico (Cu2+(aq) + 2e− → Cu(s) ).

Reazione spontanea tra Zn e ioni Cu2+.
Avviene questa reazione chimica in quanto la coppia redox (Cu2+(aq) + 2e− → Cu(s) : E° = +0,34 V) agisce da ossidante sulla coppia redox (Zn2+(aq) + 2e− → Zn ; E° = -0,76 V) che nella serie elettrochimica la segue.
Il processo complessivo è il seguente:
Zn + Cu2+ → Zn2+ + Cu
Se avessimo immerso una lamina di rame in una soluzione di ioni Zn2+ non si sarebbe avuta reazione.
In base a quanto detto F2 ossida tutti gli elementi riducenti della serie elettrochimica.
Concludendo, è possibile affermare che la serie elettrochimica consente di prevedere il senso delle reazioni che possono avvenire tra varie coppie redox.
Così, nel caso delle coppie
F2 + 2H+ + 2e− ⇄ 2 HF ; E° = +3,03 V
e
Li+ + e− ⇄ Li ; E° = -3,05 V
avviene la seguente reazione redox (bilanciata stechiometricamente):
F2 + + 2H+ + 2 Li → 2 HF + 2 Li+
Link correlati:
Esercizi svolti sull'equazione di Nernst e il calcolo del potenziale di riduzione
Esercizi svolti e commentati sulle pile
Studia con noi