Ruggine
Come e perché si forma la ruggine?
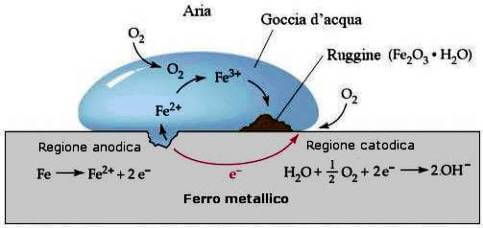
Con il termine di ruggine si indica lo strato superficiale di ossidi ferrici idrati che si forma sul ferro esposto all'azione di aria umida.
Il processo, che prende il nome di arrugginimento, è un tipico esempio di corrosione elettrochimica.
Tale processo si verifica quando un metallo facilmente ossidabile (come ad esempio il ferro) contenente impurezze anche minime di altri metalli più nobili si trova in presenza di umidità e ossigeno.
In queste condizioni si originano - nelle zone di contatto tra i due metalli - delle micropile locali in corto circuito, che provocano l'ossidazione del ferro che (essendo meno nobile) viene a costituire l'anodo della pila.
Al catodo (costituito dal metallo più nobile) avviene invece la riduzione dell'ossigeno disciolto nell'acqua che costituisce l'elettrolita.
Spiegazione del processo
Nella reazione di corrosione, il ferro metallico viene inizialmente ossidato a ione ferroso attraverso la seguente reazione redox:
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
Gli ioni ferrosi Fe2+ vengono successivamente ossidati a ioni ferrici Fe3+ dall'ossigeno disciolto nell'acqua:
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3
La reazione chimica complessiva (che si ottiene sommando le due reazione precedenti) è la seguente:
4 Fe + 3 O2 + 6 H2O → 4 Fe(OH)3
L'idrossido ferrico Fe(OH)3 così formatosi, precipita successivamente come ossido ferrico idrato:
2 Fe(OH)3 → Fe2O3·3H2O
In realtà, nella ruggine, l'ossido ferrico è presente con gradi diversi di idratazione e pertanto viene descritto con la formula Fe2O3·nH2O
Fasi della corrosione del ferro.
Parte dell'idrossido ferrico reagisce con l'anidride carbonica disciolta nell'acqua formando un carbonato che precipita insieme all'idrossido ferrico formando un solido scaglioso, friabile, di composizione non perfettamente definita, noto appunto come ruggine.
Inconvenienti della formazione della ruggine
L'arrugginimento può procedere sino a completa disgregazione dell'oggetto ferrico; tale fatto comporta importanti implicazioni industriali ed economiche.
La prevenzione è ottenuta mediante l'impiego di appropriate pitture protettive (vernici antiruggine) oppure con l'installazione di un anodo (detto anodo sacrificale) in metallo meno nobile che viene corroso a posto del ferro.
L'anodo sacrificale è costituito da una placca di metallo a potenziale minore (in genere magnesio o zinco) che, collegata elettricamente alla struttura da proteggere, si ossida al posto di essa.

Anodo sacrificale montato sullo scafo di una barca.
Questa placca con il passare del tempo si corrode e quindi deve essere periodicamente sostituita.
Link correlati:
Che cos'è e come si ottiene la passivazione di un metallo?
Come si realizza la protezione catodica?
Che cos'è e come si ottiene il ferro zincato?
Come è possibile prevenire la corrosione?
Che cos'è l'anodizzazione?
Che cos'è e come si ottiene l'acciaio zincato?
Che cos'è la nichelatura?
Vuoi sapere perchè il ferro quando arrugginisce aumenta di peso?
Studia con noi