Reazioni Esotermiche
Il calore scambiato e le reazioni esotermiche
Quando si è parlato di entalpia si è visto che il calore di reazione scambiato in una trasformazione a pressione costante è uguale alla variazione di entalpia del sistema, ovvero:
Qp = H2 - H1 = ∆H
Le reazioni esotermiche sono quelle reazioni nelle quali il sistema cede calore all'ambiente.
In questi casi si conviene di attribuire al calore segno algebrico negativo (-), quindi anche ∆H assume segno negativo (∆H < 0, cioè H2 < H1): H diminuisce.
Quindi le reazioni esotermiche sono quelle reazioni nelle quali si ha una diminuzione del valore di entalpia; in una reazione esotermica si ha che ∆H < 0.
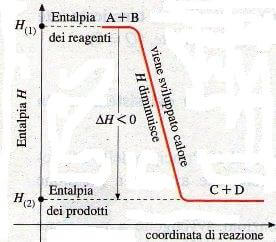
Variazione di entalpia in una reazione esotermica
In queste reazioni, l'energia potenziale di legame diminuisce, quindi una diminuzione di entalpia è sempre accompagnata da una diminuzione di energia potenziale del sistema.
Quest'ultimo, in seguito alla reazione, si assesta in uno stato di minima energia potenziale.
Una reazione esotermica viene scritta nel seguente modo:
A + B → C + D + Q
in cui A e B sono i reagenti, C e D sono i prodotti della reazione e Q è il calore prodotto. In altre parole, nelle reazioni esotermiche, oltre a prodursi C e D, si produce anche una certa quantità di calore Q.
Esempi di reazioni esotermiche
Sono esempi di reazioni esotermiche la combustione della grafite (carbonio puro) e del metano (CH4):
C(s) + O2(g) → CO2(g) per la quale Q = -94,1 kcal
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) per la quale Q = -212,9 kcal
N.B. = Q rappresenta il calore di combustione.
Esempio pratico
La reazione che produce vapor d'acqua a partire da idrogeno e ossigeno è una reazione esotermica che avviene perciò con sviluppo di calore e diminuzione di entalpia:
2H2(g) + O2(g) → 2 H2O(l) + Q
Per questa reazione si ha che:
Q = ∆H = - 136,6 kcal
ciò indica che 2 moli di H2O liquida hanno un contenuto termico complessivo inferiore di 136,6 kcal rispetto al contenuto termico complessivo di 2 moli di H2 + 1 mole di O2 considerati allo stato di gas.
Si parla più in generale di reazione esoergonica quando, oltre al calore, sono coinvolte altre forme di energia.
Studia con noi