Raffinazione dei Metalli
Raffinazione elettrolitica dei metalli
Con un procedimento simile a quello galvanoplatico, è possibile raffinare un metallo.
La raffinazione dei metalli viene condotta in una cella elettrolitica il cui anodo è costituito dal metallo da raffinare mentre il catodo è costituito da una lamina dello stesso metallo allo stato puro; il bagno elettrolitico è invece costituito da una soluzione contenente disciolto un sale del metallo da raffinare.
All'anodo il metallo da raffinare si ossida passando in soluzione come catione che si riduce al catodo depositandosi come metallo puro.
Raffinazione elettrolitica del rame
La raffinazione del rame è un processo industriale molto importante, infatti circa il 70% del rame (pari a 6 milioni di tonnellate l'anno) viene raffinato in questo modo.
Il rame metallurgico ha una purezza media del 98 - 99% ma per molti usi, ad esempio come conduttore elettrico, occorrono purezze più elevate (dell'ordine del 99,98%).
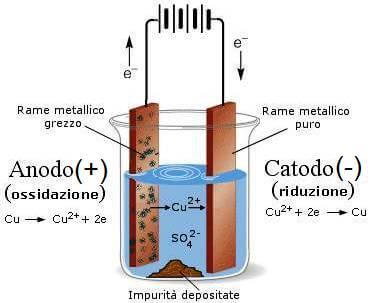
Per eseguire il processo di raffinazione elettrolitica del rame, viene utilizzata una cella elettrolitica il cui l'anodo è costituito da rame metallico grezzo (che deve essere raffinato), mentre il catodo è costituito da rame metallico puro.
Anodo e catodo sono immersi in una soluzione in una soluzione di CuSO4(aq).
Raffinazione elettrolitica del rame
I processi ai due elettrodi sono gli stessi, ma avvengono in senso opposto:
All'anodo: Cu → Cu2+ + 2e−
Al catodo: Cu2+ + 2e− → Cu
e pertanto il rame anodico manda in soluzione ioni Cu2+ che si riducono poi al catodo.
All'anodo si ha l'ossidazione del rame che passa in soluzione sotto forma di ioni rameici Cu2+ che si riducono al catodo depositandosi come rame metallico puro.
Sul fondo della cella elettrolitica si depositeranno le impurità inizialmente presenti nel rame grezzo.
Link correlati:
Che cos'è un laminatoio?
Studia con noi