Polarità delle Molecole
Come prevedere la polarità di una molecola
Un dipolo si forma quando due cariche di uguale intensità ma di segno opposto sono collocate a una certa distanza r.
Al dipolo è associato un certo momento dipolare ( µ ) dato dal prodotto tra l'intensità di carica Q e la distanza r:
![]()
Il momento dipolare può essere rappresentato da un vettore il cui verso è diretto verso il polo negativo del dipolo.
In molecole poliatomiche, i dipoli di ogni singolo legame covalente polare possono essere rappresentati con dei vettori.
La somma dei vettori determina il dipolo associato alla molecola. Pertanto, dire che una molecola ha legami covalenti polari non significa dire che molecola è polare: la polarità dipende infatti anche dalla geometria della molecola.
Come si è visto riguardo alla teoria VSEPR, ogni molecola può essere rappresentata con la formula generica AXmEn in cui:
- A = atomo centrale,
- X = atomi legati all'atomo centrale,
- E = coppie di elettroni solitarie presenti sull'atomo centrale.
Supponendo che gli atomi X legati all'atomo centrale A siano identici e che il legame tra A e X sia di tipo covalente polare, è possibile prevedere, in base alla formula generica AXmEn la polarità della molecola.
Invece, se nella molecola sono presenti solo legami covalente non polari, la molecola sarà sicuramente non polare.
La molecola dell'anidride carbonica CO2 è apolare poiché i due dipoli sono opposti e si annullano a vicenda:
![]()
Per ulteriori info si veda: molecole apolari.
La molecola dell'OF2 (ma lo stesso discorso vale per la molecola dell'acqua H2O) è polare perché i legami covalenti sono polari e disposti in maniera da non annullarsi (per ulteriori info si veda: molecole polari):
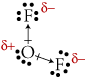
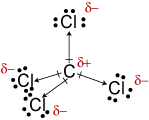
La molecola del CCl4 risulta apolare (ma lo stesso discorso vale per la molecola del metano CH4).
I quattro dipoli dei legami C—Cl, infatti, si annullano per la simmetria molecolare:
NS = 2
X—A—X
(molecola non polare)
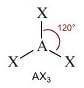
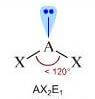
NS = 3
(molecola non polare)
(molecola polare)
NS = 4
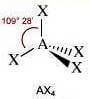
(molecola non polare)
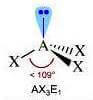
(molecola polare)

(molecola polare)
NS = 5
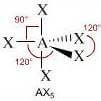
(molecola non polare)
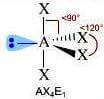
(molecola polare)
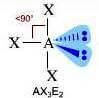
(molecola polare)
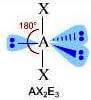
(molecola non polare)
NS = 6
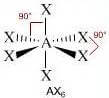
(molecola non polare)
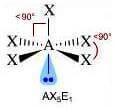
(molecola polare)
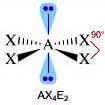
(molecola non polare)
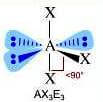
(molecola polare)
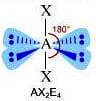
(molecola non polare)
Link correlati:
Perché la molecola dell'acqua è polare?
Studia con noi