Come si bilanciano le reazioni di ossido-riduzione
Come si bilanciano le redox con il metodo del numero di ossidazione
Oltre che con il metodo delle semireazioni, le reazione redox possono essere bilanciate con il metodo del numero di ossidazione.
Ricordiamo che le reazioni redox sono reazioni in cui si ha uno scambio di elettroni tra due specie chimiche; una specie subisce una reazione di ossidazione, l'altra specie subisce una reazione di riduzione.
È chiaro che se in una reazione chimica un elemento si riduce acquistando elettroni, dovrà esistere un altro elemento che perdendo elettroni si ossida.
Pertando le reazioni di ossidazione e di riduzione devono avvenire contemporaneamente.
Si parla quindi di reazioni redox o reazione di ossidoriduzione.
Come si bilancia una redox con il metodo del numero di ossidazione
Le varie fasi che bisogna seguire per bilanciare una reazione redox tramite il metodo del numero di ossidazione sono le seguenti:
- assegnare il numero di ossidazione agli atomi che partecipano alla redox;
- bilanciare (se necessario) gli atomi che partecipano alla redox;
- calcolare il numero di elettroni trasferiti per ogni unità formula;
- assegnare i coefficienti stechiometrici all'agente ossidante e all'agente riducente in modo tale da uguagliare il numero di elettroni ceduti e acquistati;
- bilanciare gli altri elementi in accordo con la legge di Lavoisier.
Esempio #1
Bilanciamo con il metodo del numero di ossidazione la seguente reazione:
K2Cr2O7 + H2O + S → SO2 + KOH + Cr2O3
Svolgimento
1) Assegnare il numero di ossidazione agli atomi che partecipano alla redox.
Per bilanciare la redox si prendono in considerazione inizialmente solo gli atomi che variano il loro numero di ossidazione: il numero di ossidazione di S passa da zero a +4; il cromo passa da numero di ossidazione +6 a +3.
Perciò ogni atomo di zolfo perde 4 elettroni e ogni atomo di cromo ne acquista 3.
2) Bilanciare (se necessario) gli atomi che partecipano alla redox.
In questo caso non è necessario procedere al bilanciamento degli atomi che partecipano alla redox in quanto abbiamo 2 atomi di Cr sia a sinistra che a destra e un atomo di zolfo sia a sinistra che a destra.
3) Calcolare il numero di elettroni trasferiti per ogni unità formula.
Ogni unità formula di K2Cr2O7 contiene 2 atomi di Cr, ognuno dei quali acquista 3 elettroni. In totale sono acquistati 6 elettroni.
Ogni atomo di S perde 4 elettroni.

4) Assegnare i coefficienti stechiometrici all'agente ossidante e al reagente riducente in modo tale da uguagliare il numero di elettroni ceduti e acquistati.
Poiché ogni unità formula di K2Cr2O7 contiene 2 atomi di Cr, in totale saranno acquistati 6 elettroni che devono essere necessariamente forniti dallo zolfo, ciscun atomo del quale ne mette a disposizione 4. Affinché gli elettroni ceduti ed acquistati siano in egul numero, è necessario fare reagire 2 unità formula di bicromato (12 elettroni acquistati) con 3 atomi di zolfo (12 elettroni ceduti). Ciò si indica scrivendo il numero 2 davanti a K2Cr2O7 e a Cr2O3 e a Cr2O3 e il numero 3 davanti ad S e a SO2.
![]()
5) Bilanciamo gli altri elementi in accordo con la legge di Lavoisier.
Avendo così fissato i rapporti tra ossidante e riducente, il principio di conservazione della massa (legge di lavoisier) permetterà di completare il bilanciamento delle reazione. Per cui la reazione bilanciata è:
![]()
Esempio #2
Bilanciamo con il metodo del numero di ossidazione la seguente reazione:
As2S3 + NO3− → AsO43− + S + NO + H3O+
Svolgimento
1) Assegnare il numero di ossidazione agli atomi che partecipano alla redox.
Per bilanciare la redox si prendono in considerazione inizialmente solo gli atomi che variano il loro numero di ossidazione: il numero di ossidazione di As passa da +3 a +5; il numero di ossidazione di S passa da -2 a zero; N passa da numero di ossidazione +5 a +2. Perciò ogni atomo di As perde 2 elettroni, ogni atomo di S ne perde 2 e ogni atomo di N ne acquista 3.
2) Bilanciare (se necessario) gli atomi che partecipano alla redox.
In questo caso è necessario bilanciare gli atomi di As e gli atomi di S. Gli atomi di N sono già bilanciati (due a sinistra e due a destra).
As2S3 + NO3− → 2 AsO43− + 3 S + NO + H3O+
3) Calcolare il numero di elettroni trasferiti per ogni unità formula.
Ogni molecola di As2S3 contiene 2 atomi di As, ciascuno dei quali perde 2 elettroni (totale di As = 4 elettroni persi) e 3 atomi di S ciascuno dei quali perde due lettroni (totale di S = 6 elettroni persi) . In totale sono persi 10 elettroni.
Ogni atomo di N acquista 3 elettroni.
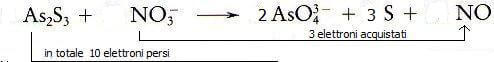
4) Assegnare i coefficienti stechiometrici all'agente ossidante e al reagente riducente in modo tale da uguagliare il numero di elettroni ceduti e acquistati
Affinché gli elettroni ceduti ed acquistati siano in egul numero, è necessario moltiplicare per 3 i coefficienti stechiometrici di As2S3 , AsO43− e S e moltiplicare per 10 i coefficienti stechiometrici di NO3− e di NO.
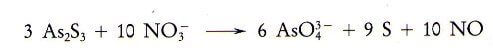
5) Bilanciamo gli altri elementi in accordo con la legge di Lavoisier.
La reazione bilanciata è:
![]()
Esercizi sul bilanciamento di reazioni redox
Li trovi al seguente link: esercizi sulle redox.
Studia con noi