Ione
Generalità e proprietà dello ione
Per ione si intende un atomo o un raggruppamento di atomi che ha assunto una o più cariche elettriche mediante perdita (ioni positivi o cationi) o acquisto (ioni negativi o anioni) di uno o più elettroni.
Gli ioni carichi positivamente sono chiamati cationi (es. Na+, NH4+) mente gli ioni carichi negativamente sono chiamati anioni (es. Cl−, CO32−).
Gli ioni vengono indicati con il simbolo chimico dell'atomo o con la formula chimica del raggruppamento di atomi a cui, come esponente, si appone un segno + per ogni carica postiva che il catione possiede o un segno - per ogni carica negativa che l'anione possiede.
Ad esempio:
Ca++ o Ca2+ indica che l'atomo di calcio ha due cariche positive (e quindi ha perso due elettroni). È un catione.
SO42− indica un raggruppamento di atomi che ha due cariche negative. È un anione.
Per gli ioni provenienti da singoli atomi (ioni monoatomici), si può dire che, in linea di massima, i cationi derivano dagli elementi a carattere metallico (per esempio lo ione K+ proveniente dal potassio, elemento a carattere metallico), mentre gli anioni derivano dagli elementi a carattere non metallico (per esempio lo ione Cl- proveniente dal cloro, elemento a carattere non metallico).
Data la presenza di carica elettrica positiva, i cationi se posti in un campo elettrico vengono attratti dal catodo (polo negativo), mentre gli anioni dall'anodo (polo positivo).
La funzione degli ioni è fondamentale in molte sostanze in cui la forza di coesione è dovuta all'attrazione elettrostatica tra ioni di carica opposta. Per esempio nel reticolo cristallino del cloruro di sodio NaCl è presente un'attrazione elettrostatica tra il catione Na+ e l'anione Cl−.
Nella formazione del legame chimico tra l'atomo Na e l'atomo Cl si generano ioni di Na+ e di Cl− in quanto l'atomo di sodio Na cede completamente all'altro uno dei suoi elettroni.
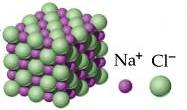
Reticolo cristallino del cloruro di sodio
Nel reticolo cristallino della sostanza NaCl non si troveranno allora singole unità di NaCl, ma una successione di ioni Na+ e di Cl− separati.
Gli elettroliti se posti in soluzione acquosa si scindono in ioni.
Si dice che l'elettrolita:
- si dissocia, se già prima di passare in soluzione era costituito da ioni;
- si ionizza se prima di passare in soluzione era costituito da molecole con legami covalenti.
Se si considerano due soluzioni acquose, una di NaCl e una di HCl, nel primo caso il cloruro di sodio (NaCl) è dissociato poiché ancor prima di passare in soluzione era costituito da ioni:
![]()
Nel secondo caso HCl è ionizzato poiché prima di passare in soluzione era costituito da molecole con legami covalenti:
![]()
Studia con noi