Esperimento di Millikan
In cosa consiste l'esperimento di Millikan?
L'esperimento di Millikan è un brillante esperimento condotto dal fisico statunitense Robert A. Millikan (1868-1953) con il quale, nel 1911, si determinò la carica elettrica dell'elettrone.
Nel 1897 il fisico e ingegnere britannico J. J. Thomson riuscì a misurare il rapporto carica/massa di un elettrone nel 1897; 14 anni dopo R. A. Millikan ottenne il valore della carica elettrica.
Descrizione dell'esperimento di Millikan
Egli irradiò con raggi X delle finissime gocce di olio spruzzate da un atomizzatore tra due piastre cariche.
I raggi X provocano l'espulsione di elettroni dagli atomi del gas dell'aria.
Questi vengono captati dalle gocce d'olio che acquistano così una, due o più cariche elettriche negative.
Millikan misurò prima la velocità di caduta nell'aria delle gocce cariche di viscosità nota.
Successivamente misurò il voltaggio da applicare, necessario per sospendere le gocce tra le piastre.
Egli calcolò che la carica elettrica su qualsiasi goccia era sempre un multiplo intero di 1,6022 · 10-19 Coulomb e, correttamente, concluse che questa doveva essere la carica di un singolo elettrone.
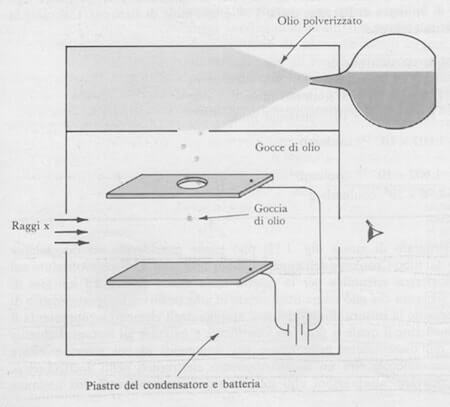
Rappresentazione schematica dell'esperimento della goccia d'olio di Millikan.
In altre parole, nell'esperimento di Millikan, piccole gocce di olio vengono immesse tra due piastre che possono essere caricate elettricamente.
Una goccia di olio viene fatta cadere liberamente attraverso l'aria e il suo percorso è registrato.
Il raggio della particelle viene calcolato dalla velocità finale di caduta e dalla viscosità dell'aria.
Se l'aria viene ionizzata con raggi X, le particelle cariche negativamente (elettroni) vengono catturate dalle gocci di olio.
La carica acquistata dalla goccia d'olio può essere calcolata dalla tensione che deve essere applicata tra la piastra del condensatore perché vi sia uguaglianza fra la forza gravitazionale e forza elettrostatica.
Si riuscì successivamente anche a determinare la massa dell'elettrone.
Calcolo del numero di Avogadro conoscendo la carica di un elettrone
Assumiamo di non conoscere il valore del numero di Avogadro ma sappiamo che il faraday è la carica necessaria a ridurre una mole di ioni Na+ e che un elettrone di Millikan si combina con ciascuno ione.
Per calcolare il numero di ioni in una mole ovvero il numero di Avogadro è sufficiente svolgere il seguente calcolo:
N = (96485 coulomb/mole) / (1,6022 · 10-19 coulomb/ione) = 6,022 · 1023 ioni/mole
Studia con noi