Elettrolisi
Elettrolisi e celle elettrolitiche
L'elettrolisi è un processo che utilizza energia elettrica per fare avvenire reazioni redox naturalmente spontanee in senso contrario.
Nelle celle elettrolitiche, avviene la trasformazione dell'energia elettrica in energia chimica.
Come viene eseguita l'elettrolisi
Supponiamo di collegare un generatore di corrente elettrica a due elettrodi di carbone immersi in NaCl fuso (in queste condizioni gli ioni Na+ e gli ioni Cl− sono liberi di muoversi).
Gli ioni Na+ vengono attratti verso l'elettrodo negativo dove si riducono a sodio metallico acquistando un elettrone mentre gli ioni Cl− si dirigono verso l'elettrodo positivo dove si ossidano cedendo il loro elettrone.
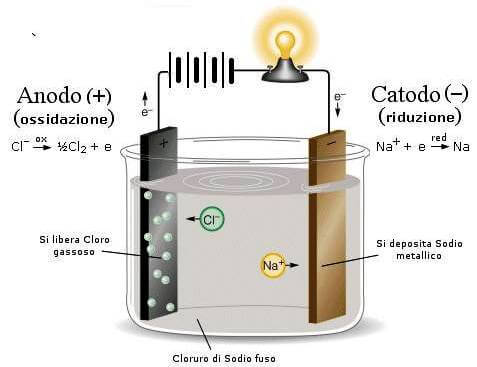
Elettrolisi del cloruro di sodio.
Poiché al catodo avviene sempre la riduzione mentre all'anodo avviene sempre l'ossidazione, nelle celle elettrolitiche il catodo è il polo negativo (-) mentre l'anodo è il polo positivo (+): i segni sono opposti a quelli di una pila.
La conduzione elettrica dovuta al movimento degli elettroni lungo il conduttore è detta conduzione di prima specie; la conduzione dovuta al movimento delle cariche nel fluido è detta conduzione elettrolitica o conduzione di seconda specie.
Le reazioni che interessano il processo di elettrolisi del cloruro di sodio fuso sono:
anodo (+): ossidazione Cl−(l) → ½ Cl2(g) + 1e−
catodo (-): riduzione Na+(l)+ 1e− → Na(l)
Somma delle reazioni Na+ + Cl- → Na(l) + ½ Cl2(g)
Tale reazione è possibile unicamente per mezzo della corrente elettrica fornita dall'esterno. In assenza di corrente elettrica sarebbe possibile solo la reazione opposta: Na + ½ Cl2(g) → Na+Cl−
Un altro processo chimicamente molto importante è l'elettrolisi dell'acqua.
Esercizi sull'elettrolisi
Li trovi al seguente link: esercizi sull'elettrolisi.
Link correlati:
Che cos'è l'elettrodialisi?
Studia con noi