Elettrolisi dell'acqua
Elettrolisi dell'acqua: come avviene
Non è possibile effettuare l'elettrolisi dell'acqua distillata perché essa è troppo poco dissociata in ioni H3O+ e OH− per permettere un apprezzabile passaggio di corrente.
Per tale motivo, per ottenere l'elettrolisi dell'acqua, si aggiungono piccole quantità di H2SO4 (o di solfato di sodio Na2SO4) allo scopo di renderla conduttrice.
Come viene condotta l'elettrolisi dell'acqua?
L'elettrolisi viene condotta in un apparecchio detto voltmetro.
Al catodo di tale apparecchio si sviluppa idrogeno H2 mentre al'anodo si sviluppa ossigeno O2.
Leggendo il volume dei due gas si può notare che il volume dell'idrogeno è doppio rispetto a quello dell'ossigeno.
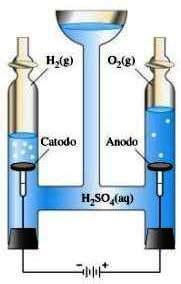
Elettrolisi dell'acqua.
Nella soluzione sono presenti le seguenti specie chimiche: H3O+, OH−, H2O, SO42−.
Data la bassa concentrazione di alcuni ioni (H3O+, OH−, SO42−) le uniche reazioni possibili sono:
al catodo: 4H2O + 4e− → 4OH− + 2H2
all'anodo: 6H2O → 4H3O+ + O2 + 4e−
Reazione globale: 10H2O → 4H3O+ + 4OH− + 2H2 + O2
Inoltre la migrazione degli ioni H3O+ e OH− permette la seguente reazione di neutralizzazione:
4H3O+ + 4OH− → 8H2O
pertanto, la reazione globale può essere scritta in questo modo:
2H2O → 2H2 + O2
nella quale è possibile notare che idrogeno e ossigeno si sviluppano nel rapporto di 2:1.
Relazione di laboratorio sull'elettrolisi dell'acqua
Se sei interessato puoi consultare la scheda di laboratorio sull'elettrolisi.
Esercizi sull'elettrolisi
Li trovi al seguente link: esercizi sull'elettrolisi.
Link correlati:
Qual è la differenza tra anodo e catodo?
Studia con noi