Diamante
Varietà ed impiego dei diamanti
Il diamante è una delle forme allotropiche del carbonio.
Cristallizza nella classe esacisottaedrica del sistema monometrico; ha una densità di 3,51 g/cm3 mentre l'indice di rifrazione è pari a 2,41 (con riga D del sodio).
Il punto di fusione è di 3550 °C, il punto di ebollizione è di 4827°C; questi sono stati determinati in atmosfera inerte perché sopra gli 800 °C in presenza di aria il diamante brucia trasformandosi in diossido di carbonio, mentre a 1000 °C in atmosfera inerte si trasforma in grafite.
Il diamante è inoltre inattaccabile dagli acidi e dagli alcali.
Si presenta in cristalli singoli o multipli di varia grandezza, generalmente ottaedrici, talvolta dodecaedrici, raramente cubici; è normalmente incolore o giallo pallido ma può essere anche azzurro, arancione, rosso, bruno.
Tagliato come gemma acquista la classica lucentezza "adamantina", dovuta agli alti valori dell'indice di rifrazione e del potere di dispersione della luce.
Il diamante rappresenta uno dei pochi casi in cui un elemento chimico (il carbonio) si rinviene in discreti quantitativi in natura allo stato puro ed è il più duro dei corpi naturali conosciuti: per questa sua proprietà rappresenta il termine di massima durezza (10) nella scala di Mohs.
I giacimenti primari più importanti si trovano nell'Africa meridionale (Repubblica Sudafricana), centrale (Zaire) e occidentale (Sierra Leone); quelli secondari, oltre che nelle stesse regioni dei primari, anche in Angola e nella Costa d'Oro.
Fuori dell'Africa, da ricordare i giacimenti secondari dell'India e del Borneo, attivi da oltre due millenni, ma oggi quasi esauriti, e quelli del Brasile che producono però soprattutto diamanti industriali.
Struttura del diamante
Nel diamante ciascun atomo di carbonio è ibridato sp3. I quattro orbitali ibridi sp3 puntano verso i vertici di un tetraedro, disponendosi a 109,5° l'uno dall'altro.
Ciascun atomo di carbonio è legato covalentemente (mediante i quattro orbitali ibridizzati sp3) ad altri quattro atomi C.
Ogni diamante è quindi una molecola unica (solido covalente) costituita da un enorme numero di atomi C distanti 0,154 nm l'uno dall'altro.
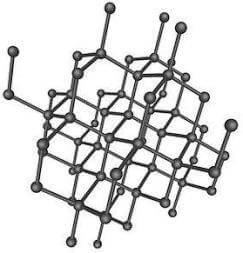
Struttura del diamante
Proprietà fisiche e chimiche del diamante
Gli elettroni del diamante sono tutti impegnati nei legami covalenti e pertanto il diamante è un isolante elettrico; se contiene impurezze può manifestare proprietà di semiconduttore.
L'elevato valore dell'indice di rifrazione (n = 2,407 per la luce rossa; n = 2,465 per la luce violetta) impartisce al diamante la caratteristica proprietà di decomporre la luce bianca nei suoi colori costitutivi.
Aggiungiamo che il diamante ha una eccezionale conducibilità termica (circa 5 volte maggiore di quella del rame); l'energia termica non è però trasmessa dagli elettroni, come nei metalli, ma, come in tutti i non metalli, dalle vibrazioni delle particelle; la rigidità del reticolo cristallino e il basso peso dell'atomo di carbonio spiegano la sua elevata conducibilità termica.
Per le stesse ragioni, anche il suono si trasmette nel diamante con elevata velocità (18000 metri/ secondo contro 9000 nell'acciaio e 344 nell'aria).
Il diamante è chimicamente assai inerte: una soluzione di dicromato di potassio (K2Cr2O7) in acido solforico concentrato (fortemente ossidante) a circa 200°C, ossida il carbonio del diamante solo assai lentamente:
2 K2Cr2O7 + 8 H2SO4 + 3 C → 2 Cr2(SO4)3 + 2 K2SO4 + 8 H2O + 3 CO2
Varietà ed impiego dei diamanti
I diamanti vengono classificati, in base a criteri commerciali determinati dal grado di purezza e dalle dimensioni, in gemme e diamanti industriali.
Si stabiliscono in genere tre gradi di purezza:
- diamante purissimo (o di prima acqua), assolutamente trasparente e incolore, senza la minima traccia di imperfezioni. Una volta tagliato come gemma manda lampi di luce di un bianco abbagliante;
- diamante puro (o di seconda acqua), che differisce dal precedente solo perché ha una lievissima, quasi impercettibile colorazione giallina;
- diamante non puro (o di terza acqua), appena più colorato oppure con una leggera imperfezione all'interno, dovuta ad un difetto di cristallizzazione.
I diamanti troppo piccoli o che presentino impurezze troppo grandi sono destinati all'uso industriale.
Tipici diamanti ad uso industriale sono:
- la varietà bort, sudafricana, che si presenta in cristalli rotondeggianti, opachi, a struttura fibrosa;
- la varietà carbonado, brasiliana, in cristalli grossi come piselli ma neri e opachi come il coke.
Uso industriale dei diamanti
Le qualità migliori dei diamanti industriali, rappresentate dai diamanti con un grado di purezza immediatamente inferiore alle gemme più scadenti, vengono usate per armare la parte lavorante degli utensili destinati alla produzione dei diamanti stessi o per ricavarne delle speciali filiere (con diametro inferiore a ⅒ di mm) per la trafilatura a caldo dei filamenti di tungsteno delle lampade a incandescenza.
I frammenti di scarto della lavorazione delle gemme e i più piccoli cristalli allo stato greggio sono impiegati come utensili per tagliare vetri e cristalli e per la preparazione e la rettifica di mole abrasive di corindone o di carburo di silicio.
Il bort e il carbonado (menzionati in precedenza) sono usati soprattutto per armare le teste cilindriche delle perforatrici da roccia dell'industria estrattiva.
I diamanti sintetici, costituiti sempre da un unico cristallo ottaedrico, si prestano ottimamente alla fabbricazione di dischi diamantati usati per la lavorazione e la rifinitura di utensili in carburo di tungsteno.
L'unità di misura di peso del diamante è il carato metrico (⅕ di grammo).
Link correlati:
Che cos'è il diamante sintetico?
Qual è la struttura chimica del diamante?
Che cosa significa oro 24 carati?
Quale posizione occupa il diamante nella scala della durezza di Mohs?
Esercizio sul calcolo dell'indice di rifrazione del diamante
Studia con noi