Diagramma di stato dell'acqua
Spiegazione del diagramma di stato dell'acqua
Il diagramma di stato di una sostanza pura è un diagramma che permette di conoscere, in funzione della temperatura e della pressione, i campi di esistenza di ciascuno stato di aggregazione della specie considerata e di definire le condizioni alle quali coesistono in equilibrio più stati di aggregazione della stessa specie (solido, liquido e vapore).
Come si disegna il diagramma di stato dell'acqua
Si immagini di riempire parzialmente con acqua un recipiente trasparente, chiuso, munito di termometro e di manometro.
All'interno del recipiente munito di coperchio viene fatto il vuoto, e poi viene raffreddato, ad esempio, alla temperatura di - 70 °C.
A questa temperatura l'acqua è presente negli stati solido e vapore (vapore acqueo).
Si forniscono piccole e calibrate quantità di calore al sistema e ad ogni aggiunta, si rilevino i valori di temperatura e di pressione.
Man mano che viene somministrato calore, la temperatura aumenta e il sistema, inizialmente costituito da solido/vapore, si trasforma prima in un sistema costituito da solido/liquido/vapore, poi in liquido/vapore e infine, raggiunta la temperatura critica (374,1 °C) scompare la separazione fra queste due fasi e risulta costituito dalla sola fase critica.
Mediante l'utilizzo di un diverso apparato sperimentale si misuri ora la temperatura di fusione del ghiaccio (equilibrio (H20)s ⇄ (H20)l) al variare della pressione applicata mediante un pistone al sistema acqua-ghiaccio.
I dati raccolti nei due esperimenti descritti in precedenza, permette di disegnare il diagramma di stato dell'acqua, che viene descritto di seguito in dettaglio.
Studio del diagramma di stato dell'acqua
Nella figura seguente è riportato il diagramma di stato dell'acqua:
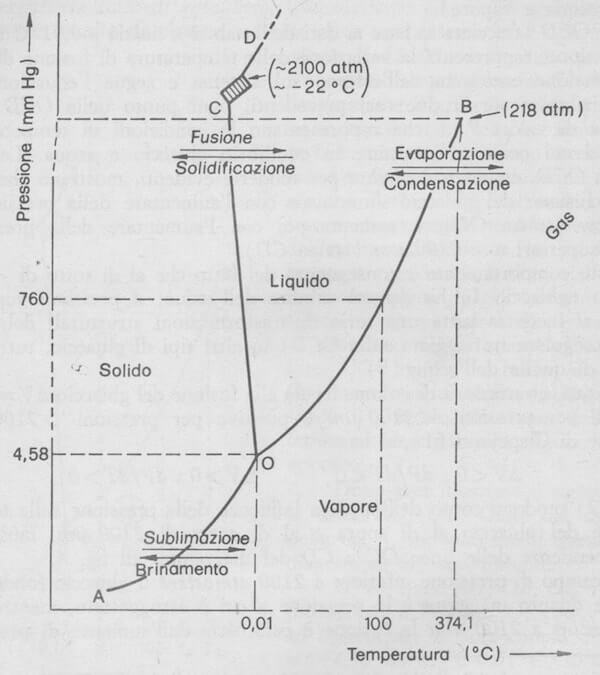
Diagramma di stato dell'acqua: come si può notare gli assi delle pressioni e delle temperature del diagramma presentano delle parti tratteggiate poiché non sono in scala.
Il grafico è suddiviso in tre porzioni che rappresentano i campi di esistenza rispettivamente del solido (ghiaccio), del liquido e del vapore; in esso sono presenti inoltre tre linee che andiamo a commentare.
Linea AO: rappresenta la variazione della pressione di vapore del ghiaccio con la temperatura. Essa ha teoricamente inizio allo zero assoluto e cessa con la fusione del ghiaccio (0,01 °C*) e il suo andamento segue l'equazione di Clapeyron. Tale tratto di curva definisce i valori di T e di P ai quali il ghiaccio sublima (o il vapore d'acqua brina). Le coordinate della linea AO rappresentano i valori di T e di P ai quali esiste un equilibrio del sistema ghiaccio-vapore.
* Si ricordi che l'esperienza è condotta in recipiente chiuso e inizialmente vuoto: è in queste condizioni che il ghiaccio fonde a +0,01 °C, temperatura a cui corrisponde una pressione di vapore di 4,58 mmHg.
Linea OB: rappresenta la variazione della pressione di vapore dell'acqua con la temperatura; anche in questo caso il suo andamento segue l'equazione di Clapeyron. Essa ha inizio alla temperatura di 0,01°C e cessa a 374,1°C (temperatura critica dell'acqua al di sopra della quale non ha più senso fare distinzione tra liquido e vapore in quanto esiste un'unica fase: la fase critica). Tale tratto di curva definisce i valori di T e di P ai quali esiste un equilibrio del sistema liquido-vapore.
Il punto B del diagramma rappresenta il punto critico dell'acqua.
Linea OCD: rappresenta la variazione della temperatura di fusione del ghiaccio con la pressione esercitata dall'esterno sul sistema; anche in questo caso il suo andamento segue l'equazione di Clapeyron. Essa ha inizio alla temperatura di 0,01°C e tale tratto di curva definisce i valori di T e di P ai quali esiste un equilibrio del sistema solido-liquido. Le pendenze della linea OCD (esagerate in figura per renderle evidenti) mostrano che:
- sino alla pressione di 2100 atm, la temperatura di fusione del ghiaccio diminuisce con l'aumentare della pressione (tratto OC);
- per pressioni superiori a 2100 atm la temperatura di fusione del ghiaccio aumenta con l'aumentare della pressione, (tratto CD).
Questo comportamento è conseguenza del fatto che al di sotto di 2100 atm il ghiaccio (ghiaccio I) ha densità minore dell'acqua; a pressioni superiori alle 2100 atm si incontra tutta una serie di trasformazioni strutturali del ghiaccio I (zona rettangolare tratteggiata sulla OCD) in altri tipi di ghiaccio, tutti a densità maggiore di quella dell'acqua. Pertanto la variazione di volume legata alla fusione del ghiaccio ΔV=Vliq-Vsol, è negativa per pressioni inferiori a 2100 atm e positiva per pressioni superiori a 2100 atm.
Per l'equazione di Clapeyron, si ha che:
- per ΔV < 0 : dP / dT < 0
- per ΔV > 0 : dP / dT > 0
Queste due equazioni rendono conto dell'opposta influenza della pressione sulla temperatura di fusione del ghiaccio al di sopra e al di sotto di 2100 atm, mostrata dalle opposte pendenze delle linee OC e CD del diagramma precedente. Nel campo di pressione inferiore a 2100 atmosfere il ghiaccio fonde tanto più facilmente quanto maggiore è la pressione a cui è assoggettato, mentre per pressioni superiori a 2100 atm la fusione è ostacolata dall'aumento di pressione.
È importante fare notare infine che le tre linee AO, OB e OC si incontrano nel punto O, che viene così ad individuare un punto univoco di valori di pressione e di temperatura in corrispondenza dei quali coesistono in equilibrio ghiaccio, acqua e vapore. Il punto O viene indicato perciò col nome di punto triplo dell'acqua.
Simile a quello dell'acqua è il diagramma di stato dell'anidride carbonica.
Studia con noi