Crioscopia
Che cos'è la crioscopia?
La crioscopia è quella branca della chimica che studia la variazione del punto di congelamento di una soluzione rispetto a quella del solvente puro.
Il fenomeno è chiamato abbassamento crioscopico.
Alla base di questo fenomeno è l'abbassamento della tensione di vapore di un solvente per effetto della presenza di un soluto; per le soluzioni ideali questo abbassamento è governato dalla legge di Raoult.
Secondo questa legge una soluzione contenente un soluto non volatile presenta sempre una tensione di vapore più bassa di quella del solvente puro.
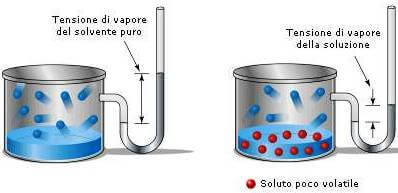
La tensione di vapore della soluzione è inferiore a quella del solvente puro.
In particolare, l'abbassamento della temperatura di congelamento (abbassamento crioscopico) Δtcr di una soluzione rispetto a quella del solvente puro è direttamente proporzionale alla molalità (m) della soluzione:
![]()
in cui:
- Δtcr è l'abbassamento crioscopico, uguale alla temperatura di congelamento della soluzione meno quella del solvente puro;
- m è la molalità della soluzione;
- Kcr è la costante crioscopica.
Kcr varia da solvente a solvente e per l'acqua vale 1,86 (°C · kg) / mol.
Se la sostanza disciolta è dissociata in ioni, bisogna anche introdurre il coefficiente i di Van't Hoff.
Questo può accadere per alcune sostanze come ad esempio il cloruro di sodio (i = 2), il solfato di sodio (i = 3), il cloruro di calcio (i = 3).
Esso vale 2, 3, 4, .... a seconda del numero di ioni in cui l'elettrolita è dissociato.
Si ha pertanto che la formula precedente diventa:
![]()
Per esempio:
- nel caso del solfato di sodio (Na2SO4 → 2Na+ + SO42−) i = 3;
- nel caso dell'acido cloridrico (HCl → H+ + Cl−) i = 2;
- nel caso del cloruro di sodio (NaCl → Na+ + Cl−) i = 2;
- nel caso del cloruro di calcio (CaCl2 → Ca2++ 2 Cl−) i = 3.
Link correlati:
Studia con noi