Corrosione
Fenomeni elettrochimici di interesse pratico: la corrosione
A pH = 7 (pH neutro, [OH−] = 10-7), il potenziale di riduzione della reazione
2H2O + 2e− → H2 + 2OH−
vale E°H2O/H2 = -0,42 Volt.
L'acqua pura (distillata) a pH = 7 è quindi in grado di ossidare tutti i metalli che hanno un potenziale standard di riduzione inferiore a -0,42 volt come ad esempio lo zinco (-0,76V), l'alluminio (-1,66V) e tutti i metalli alcalini e alcalino-terrosi.; non è invece in grado di ossidare il ferro in quanto il suo potenziale standard di riduzione è pari a -0,44 volt praticamente uguale a quello dell'acqua pura.
Tuttavia, se nell'acqua è disciolto ossigeno, essa può dare luogo alla seguente semireazione di riduzione:
H2O + ½ O2 + 2e− → 2OH−
il cui potenziale di riduzione standard vale E°= +0,40 V
A pH = 7 la reazione precedente presenta un potenziale di riduzione pari a +0,81 V ed è pertanto in grado di ossidare non solo il ferro (E°= -0,44 V) ma anche lo stagno (E°= - 0,14 V), il piombo (E°= -0,13 V) e il rame (E° = +0,34 V).
Corrosione e arrugginimento
L'ossidazione del ferro ad opera dell'acqua è una reazione nota con il termine di arrugginimento.
In tale reazione di corrosione, il ferro metallico viene inizialmente ossidato a ione ferroso attraverso la seguente reazione redox:
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
gli ioni ferrosi Fe2+ vengono successivamente ossidati a ioni ferrici Fe3+ dall'ossigeno disciolto nell'acqua:
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3
La reazione totale che si ha e che si ottiene sommando le due reazione precedenti è la seguente:
4 Fe + 3 O2 + 6 H2O → 4 Fe(OH)3
L'idrossido ferrico così formatosi, precipita successivamente come ossido ferrico idrato attraverso la seguente reazione:
2 Fe(OH)3 → Fe2O3·3H2O
In realtà, nella ruggine, l'ossido ferrico è presente con gradi diversi di idratazione e pertanto viene descritto con la formula Fe2O3·nH2O
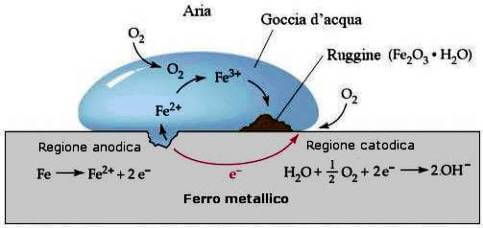
Fasi della corrosione del ferro.
Parte dell'idrossido ferrico reagisce con l'anidride carbonica disciolta nell'acqua formando un carbonato che precipita insieme all'idrossido ferrico formando un solido scaglioso, friabile, di composizione non perfettamente definita, noto come ruggine.
Per proteggere le superfici metalliche dalla ruggine vengono utilizzate particolari vernici con proprietà antiruggine.
Link correlati:
Come si realizza la protezione catodica?
Come è possibile prevenire la corrosione?
Esercizio svolto e commentato sulla corrosione
Che cos'è e come si ottiene l'acciaio zincato?
Studia con noi