Catalisi
Che cos'è la catalisi?
La catalisi è il fenomeno secondo cui alcune reazioni chimiche vengono accelerate o ritardate dalla presenza di opportune sostanze note con il nome di catalizzatori.
Il termine "catalisi" - che fu introdotto nel 1836 da Berzelius - deriva dal greco katàlysis (scioglimento); con tale termine si voleva esprimere l'azione tipica del catalizzatore, che velocizzando la reazione, "scioglieva" i vincoli che la frenano.
I catalizzatori sono quindi sostanze che, aggiunte in piccole quantità, modificano il valore della velocità di reazione senza venir consumati durante la reazione stessa.
I catalizzatori non compaiono nelle equazioni globali di reazione e non provocano variazioni del valore della costante di equilibrio ma facilitano il raggiungimento dell'equilibrio stesso, offrendo alla reazione un "percorso" alternativo più veloce (cioè con reazioni chimiche intermedie diverse, per le quali è richiesta un'energia di attivazione minore).
L'energia di attivazione è l'energia minima che le molecole devono possedere durante l'urto, affinché la reazione avvenga.
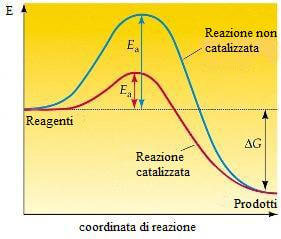
Il catalizzatore fornisce un percorso di reazione con una energia di attivazione inferiore rispetto alla reazione non catalizzata.
Catalisi omogenea e catalisi eterogenea
La catalisi può essere classificata in:
- catalisi omogenea: se i reagenti, i prodotti e il catalizzatore appartengono alla stessa fase (per esempio un catalizzatore liquido per reagenti liquidi);
- catalisi eterogenea: se il catalizzatore è in una fase diversa dalla fase dei reagenti (per esempio un catalizzatore solido per reagenti liquidi).
La catalisi omogenea in fase gassosa è abbastanza frequente. Un esempio è la reazione fra anidride solforosa (SO2) e ossigeno (O2) per la produzione di anidride solforica (SO3), catalizzata dal monossido di azoto (NO).
Molto frequente è invece la catalisi omogenea in soluzione i cui catalizzatori possono essere sia ioni (in particolare ioni idrogeno, H+) che elementi metallici.
Come esempio di catalisi eterogenea si può ricordare la reazione fra idrogeno (H2) e ossigeno (O2) gassosi:
2 H2 + O2 → 2 H2O
Tale reazione - in assenza di catalizzatore - non avviene; se catalizzata da platino spugnoso diventa esplosiva.
Studia con noi