Allotropia
Il fenomeno dell'allotropia
Il termine allotropo indica una delle forme sotto cui può pesentarsi un elemento chimico che differisce dalle altre per struttura cristallina e proprietà chimiche e proprietà fisiche.
Esempi di sostanze che hanno forme allotropiche sono il carbonio (che può presentarsi sotto le forme di diamante, grafite e fullerene), il fosforo (che può presentarsi nelle forme di fosforo nero, fosforo rosso e fosforo bianco), lo zolfo (che può presentarsi nelle forme di zolfo λ con molecole a otto atomi e di zolfo µ a catena lineare).
Le trasformazioni con cui si passa da una forma allotropica all'altra al variare della temperatura e in presenza di catalizzatori sono dette trasformazioni allotropiche.
Le forme allotropiche di una sostanza non devono essere confuse con i possibili stati fisici della stessa. Per esempio l'acqua esiste in tre diversi stati fisici: solido, liquido e vapore.
Questi stati fisici (che non sono diverse forme allotropiche dell'acqua) si diversificano per la forze dei legami fisici esistenti tra le diverse molecole.
Le varie forme allotropiche di una sostanza sono invece dovute ai diversi legami chimici esistenti fra atomi dello stesso tipo.
Forme allotropiche del carbonio
Il carbonio è un elemento chimico che può esistere in tre diverse forme allotropiche.
Nel diamante ciascun atomo di carbonio è legato covalentemente (mediante quattro orbitali ibridi sp3) ad altri quattro atomi di carbonio: si viene a formare in questo modo un'unica macromolecola costituita da un enorme numero di atomi di carboni distanti 0,154 nm (1 nm = 1 nanometro = 10-9 m = milionesimi di millimetro) l'uno dall'altro.
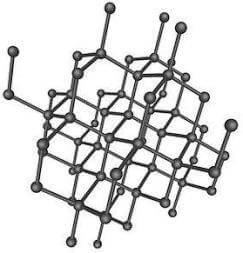
Struttura del diamante
Gli elettroni di valenza sono tutti impegnati nei legami chimici ed il diamante è pertanto un isolante elettrico.
Per approfondimenti si veda: struttura del diamante.
La grafite ha una struttura a strati legati tra loro da deboli forze di Van der Waals. All'interno di ogni strato ogni atomo di carbonio è legato (mediante orbitali ibridi sp2) ad altri tre atomi di carbonio.

Struttura della grafite
Il fullerene ha una struttura simile ad un pallone da calcio. In esso i 60 atomi di carbonio che lo compongono atomi di carbonio vengono a formare rispettivamente esagoni e pentagoni disposti in modo tale da formare strutture sferoidali.
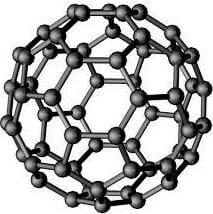
Struttura del fullerene
Si noti infine che le varie forme allotropiche di una stessa sostanza possono differire sia nelle caratteristiche fisiche che nella reattività chimica.
Oltre al fullerene propriamente detto, esistono anche altri fullereni.
Studia con noi