Solfato di rame (solfato rameico)
Proprietà e caratteristiche del solfato di rame
Il solfato di rame, noto anche come solfato rameico CuSO4 è un sale anidro che ha l'aspetto di una polvere bianca e che si ottiene per riscaldamento del solfato di rame pentaidrato CuSO4·5H2O a circa 200°C.
Per riscaldamento a 100°C del pentaidrato si ottiene il monoidrato, in polvere bianca verdastra, mentre lasciando il pentaidrato in atmosfera d'aria secca si ottiene il triidrato, in polvere azzurra.
Il solfato di rame pentaidrato è in cristalli triclini, colorati in azzurro intenso, di sapore astringente, disgustoso e molto velenoso. All'aria secca sfioriscono.

Proprietà fisiche e chimiche del solfato di rame
Le soluzioni acquose di solfato di rame hanno reazione acida al tornasole; per ebollizione si idrolizzano e possono separare il solfato basico.
Il solfato di rame cristallizzato è praticamente insolubile nell'alcool etilico.
Trattando con un eccesso di ammoniaca una soluzione acquosa di solfato di rame ed aggiungendo alcol, si separano cristalli azzurro-violetti corrispondenti al tetraammoniacato monoidrato CuSO4 · 4NH3 · H2O.
Facendo agire l'ammoniaca gassosa sul solfato di rame anidro si forma invece il pentaammoniacato CuSO4 · 5NH3, sotto forma di polvere azzurro-violetta.
Struttura del CuSO4
Preparazione industriale del solfato di rame
Il solfato rameico si prepara industrialmente attaccando il rame (granaglie) con l'acido solforico a 50-55 °Bè in corrente d'aria:
Cu + H2SO4 + ½ O2 → CuSO4 + H2O
L'aria è necessaria per compiere la reazione a temperatura intorno a 70-80 °C; essa attacca superficialmente il metallo formando ossido rameico che reagisce facilmente con l'acido solforico anche diluito; in assenza di aria e sopra 130°C avviene la seguente reazione (con perdita di SO2):
Cu + 2 H2SO4 → CuSO4 + 2 H2O + SO2
Usi del solfato di rame
Il solfato di rame trova applicazioni come anticrittogamico e reagente analitico.
Uso del solfato di rame (rameico) in ambito didattico
Il solfato rameico viene spesso utilizzato in ambiente didattico per fare comprendere agli studenti il funzionamento dei sali idrati.
Mettendo in stufa il solfato di rame pentaidrato CuSO4·5H2O di colore azzurro si ottiene, dopo un tempo variabile dipendente dalla temperatura della stufa, il sale anidro CuSO4 di colore bianco. Aggiungendo qualche goccia di acqua al sale anidro, si riottiene la forma pentaidrata di colore blu.
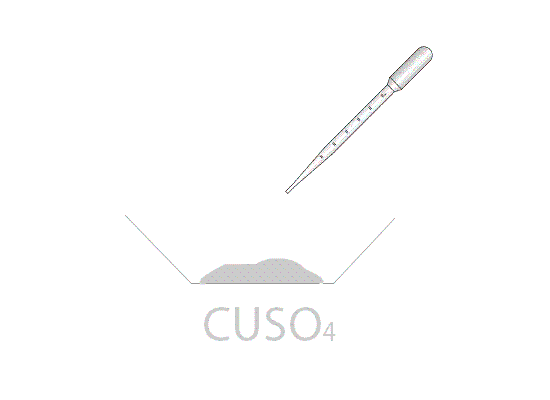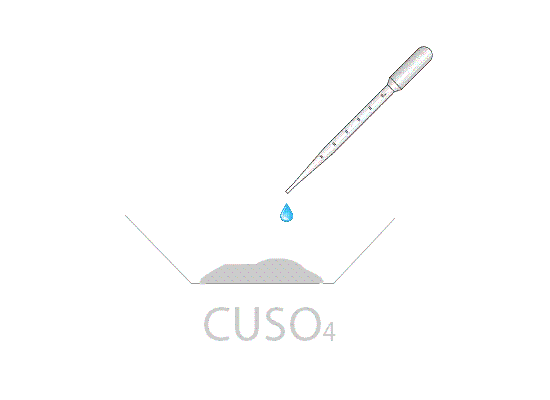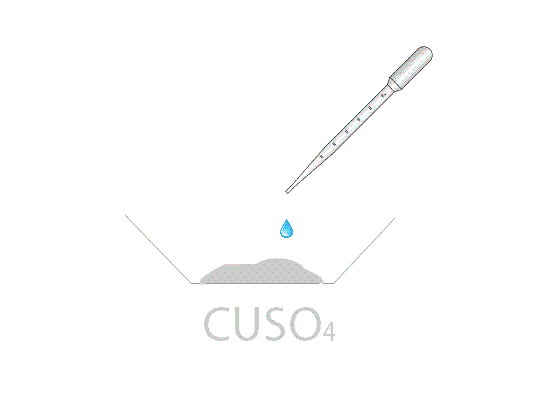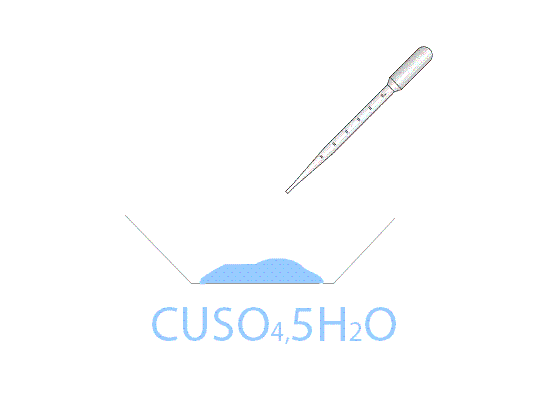
Nei laboratori di chimica il solfato di rame viene utilizzato anche per spiegare le reazioni di scambio semplice. Infatti, immergendo una barretta di zinco all'interno di una soluzione di solfato di rame (dissociata in ioni Cu2+ e in ioni SO42−), è possibile notare l'ossidazione dello zinco a Zn2+ e la contemporanea riduzione degli ioni Cu2+ a rame metallico. La soluzione blu di CuSO4 tende, a reazione ultimata, all'incolore; la causa è dovuta alla scomparsa dello ione Cu2+ che colorava la soluzione.

Reazione spontanea tra Zn e ioni Cu2+
Il solfato di rame viene utilizzato anche nella prova di laboratorio riguardante la cristallizzazione del solfato di rame pentaidrato impuro e lo si trova anche il alcuni giochi didattici come "Il piccolo chimico" o "Il grande laboratorio di chimica" che sono indubbiamente ottime idee regalo.
Studia con noi