Solfato di ammonio
Proprietà e caratteristiche del solfato di ammonio
Il solfato di ammonio è un sale con formula chimica (NH4)2SO4.
Fu ottenuto da Glauber nel XVII secolo da acido solforico e ammoniaca.
È stato uno dei primi prodotti in grande scala dell'industria chimica, essendosene sviluppata la fabbricazione sin dagli inizi del XIX secolo come sottoprodotto della distillazione dei carboni fossili.
Proprietà fisiche del solfato di ammonio (NH4)2SO4
Il solfato ammonico è un sale che ha un contenuto in azoto del 21,33%. Il prodotto commerciale ha un titolo medio del 20,5 - 21%. Cristallizza nel sistema ortorombico.
Per riscaldamento elimina ammoniaca trasformandosi successivamente in idrogenosolfato di ammonio NH4HSO4, nel sale doppio NH4HSO4·H2SO4 e nel pirosolfato (NH4)2S207.
La forma dei cristalli che si separano dalle soluzioni acquose di solfato di ammonio è sensibile alla presenza di sostanze estranee: per esempio, in presenza di ioni trivalenti di Fe, Cr e Al, i cristalli tendono ad assumere un habitus aghiforme, mentre gli ioni ferrosi, manganosi e cobaltosi ne favoriscono la crescita in grossi elementi, di aspetto tozzo.

Proprietà chimiche del solfato di ammonio
Il solfato ammonico nelle sue soluzioni acquose è decomposto dalle sostanze ossidanti, in misura diversa a seconda dalla natura dell'ossidante; per esempio con bromo dà:
2 NH4+ + 3 Br2 → 6 Br− + 8 H+ + N2
Con permanganato di potassio e perossido d'idrogeno libera ammoniaca:
2 KMnO4 + 5 H2O2 + 3 (NH4)2SO4 → K2SO4 + 2 MnSO4 + 8 H2O + 5 02 + 6 NH3
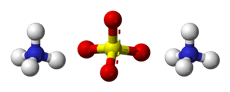
Struttura del solfato di ammonio
Ioni equivalenti: NH4+ , SO42− , NH4+
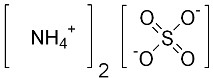
Struttura 3D
Produzione del solfato di ammonio
I processi industriali di produzione del solfato di ammonio si basano su tre diverse reazioni:
a) neutralizzazione dell'acido solforico con ammoniaca (NH3):
H2SO4(l) + 2 NH3(g) → (NH4)2SO4(s) + 66,03 KCal
b) carbo-ammonizzazione del solfato di calcio in acqua:
CaSO4 + CO2 + 2 NH3 → (NH4)2SO4(aq) + CaCO3(s)
c) ossidazione delle soluzioni di solfato ed idrogenosolfato d'ammonio ottenute dal recupero di SO2 da gas:
2 (NH4)2SO3 + O2 → 2 (NH4)2SO4
Impieghi del solfato di ammonio, (NH4)2SO4
L'uso di gran lunga più importante del solfato di ammonio è quello per i concimi chimici la cui produzione è stata predominante rispetto a tutti gli altri composti azotati fino al 1958; successivamente essa è andata perdendo d'importanza relativa, per la preferenza sempre più largamente accordata a prodotti con titolo di azoto maggiore (per esempio nitrato di ammonio e urea).
Studia con noi