Clorato di potassio
Proprietà e caratteristiche del clorato di potassio
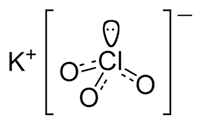
Il clorato di potassio è un sale ternario con formula chimica KClO3.
Al disopra di 400°C si decompone in perclorato e cloruro :
4 KClO3 → 3 KClO4 + KCl
La reazione viene catalizzata per aggiunta di alcune sostanze (MnO2, Fe2O3, CuO) cosicché può avvenire a temperature più basse e quindi prima della fusione (tf = 356°C).
Riscaldando ulteriormente, il perclorato si decompone completamente in cloruro ed ossigeno:
KClO4 → KCl + 2 O2
Mescolato con sostanze ossidanti (polvere di alluminio, sostanze organiche) il clorato forma miscele esplosive. Il loro impiego, a causa della sensibilità all'urto ed allo sfregamento, è pericoloso.
Struttura del clorato di potassio
Lo ione clorato ha una struttura piramidale nella quale il cloro occupa il vertice di una piramide a base triangolare i cui vertici di base sono occupati dagli atomi di ossigeno.
Preparazione del clorato di potassio
I procedimenti industriali di preparazione del clorato potassico sono due: per via chimica e per via elettrolitica.
Il processo chimico consiste nel trattamento dell'idrossido di calcio a 65°C con un eccesso di cloro; si forma così il clorato di calcio:
6 Ca(OH)2 + 6 Cl2 → 5 CaCl2 + Ca(ClO3)2 + 6 H2O
In una seconda fase il clorato di calcio si trasforma in clorato potassico per aggiunta di cloruro di potassio. Concentrando la soluzione ottenuta e raffreddando, cristallizza il clorato potassico che si purifica per ricristallizzazione.
Oggi però il clorato di potassio è quasi esclusivamente usata la via elettrolitica.
Impieghi del clorato di potassio
Il clorato potassico è usato soprattutto nella fabbricazione dei fiammiferi, con un titolo minimo del 99,7%, ed in pirotecnica; non può essere sostituito, in questi usi, dal clorato di sodio che è troppo igroscopico.
Il KClO3 trova impiego inoltre in farmacia ed in bagni di riscaldamento.
Un uso interessante si ha mescolando clorato di potassio con ossidi metallici (MnO2) che catalizzano lo svolgimento d'ossigeno.
2KClO3 → 2 KCl + 3O2
Simili miscele si impiegano come sorgenti di ossigeno puro, in laboratorio, per riscaldamento (70-100 °C).
Il clorato fuso è inoltre un potente ossidante, così come lo sono le soluzioni acide, in cui si ha sviluppo di acido clorico, mentre le soluzioni neutre e basiche non hanno proprietà ossidanti.
Infatti, il potenziale della semireazione fatta avvenire in soluzione acquosa acida:
Cl2 + 6 H2O ⇄ 2 ClO3− + 12 H+ + 10 e−
è E° = - 1,47 volt e indica che lo ione ClO3− ha lo stesso potere ossidante dello ione MnO4−.
I clorati, misti con sostanze organiche, possono essere utilizzati come esplosivi, ma il loro uso è limitato in quanto sono troppo sensibili agli urti. Infatti le miscele clorati + zucchero, clorati + zolfo + carbone (miscela che costituisce la polvere da sparo) esplodono con la massima facilità per semplice percussione.
Link correlati:
Come sono fatti i fiammiferi svedesi?
Studia con noi