Tiofene
Proprietà e caratteristiche del tiofene (tiofurano)
Il tiofene, noto anche con il nome di tiofurano, è un composto aromatico eterociclico formato da quattro atomi di carbonio ed uno di zolfo legati in un anello a cinque atomi.
Presenta la seguente struttura:
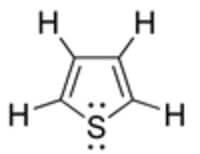
Ha massa molare di 84,14 g/mol, punto di fusione di -38°C, punto di ebollizione di 84°C e densità di 1,05 g/cm3.
Il tiofene si trova come impurezza nel benzene commerciale prodotto dal carbone fossile; fu infatti scoperto la prima volta come impurezza nel benzene proveniente dal carbon fossile dal chimico tedesco Victor Meyer nel 1882.
È un liquido incolore, insolubile in acqua, ma solubile in etanolo, in etere etilico e in tutti i più comuni solventi organici, di odore e comportamento chimico simili al benzene, a cui, come già detto, si trova unito nelle sue fonti naturali (non è facilmente separabile dal benzene avendo i due componenti punti di ebollizione molto vicini).
Chimica del tiofene
Le forme di risonanza più importanti e il sistema di numerazione usato per il tiofene sono mostrati qui di seguito:
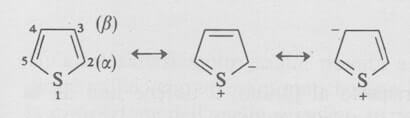
L'energia di coniugazione del tiofene è stata stimata in 29 kcal/moli, che è assai più grande di quella del furano e abbastanza vicina a quella del benzene.
È stato suggerito che il fattore che probabilmente contribuisce alla insolita stabilità del tiofene è una modesta partecipazione degli orbitali 3d dell'atomo di zolfo al sistema legante degli orbitali π.
Il tiofene è molto più stabile agli acidi rispetto al furano ma anch'esso forma polimeri con acidi sufficientemente forti, come l'acido solforico fumante, l'acido fluoridrico liquido e il cloruro di alluminio.
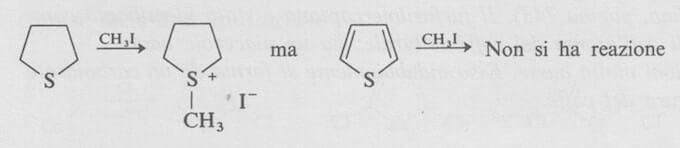
La bassa nucleofilicità del tiofene è mostrata dal fatto che non reagisce con lo ioduro di metile per dare il sale di solfonio mentre il tetraidrotiofene (a sinistra della figura seguente) reagisce facilmente con ioduro di metile come è mostrato qui di seguito.
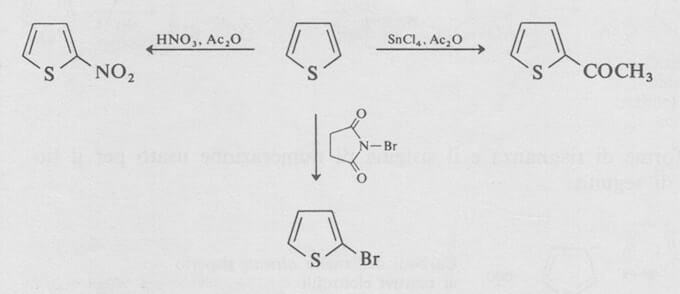
Il tiofene dà sostituzioni elettrofile aromatiche molto più rapidamente del benzene. La posizione α viene attaccata più facilmente.
Si devono usare condizioni di reazione blande per evitare la polimerizzazione del tiofene e per ottenere solo i prodotti monosostituiti.
In accordo con la maggiore stabilità del tiofene rispetto al furano, il tiofene non dà la reazione di Diels-Alder con reattivi dienofili come l'anidride maleica.
Sintesi del tiofene
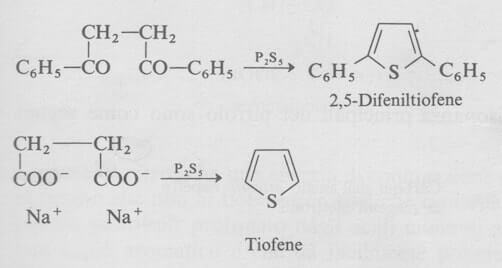
La sintesi più generale dei tiofeni da precursori a catena aperta consiste nello scaldare un composto 1,4-dicarbonilico in presenza di pentasolfuro di fosforo (P2S5).
Questo metodo è più largamente applicabile di quello per l'analoga sintesi dei furani, poiché uno o entrambi i carbonili reagenti possono essere sotto forma di ione carbossilato, che viene ridotto nel caso della reazione.
Lo stesso tiofene è stato sintetizzato per la prima volta in questo modo, partendo dal succinato di sodio (Na+-OOC-CH2-CH2-COO−Na+).
L'attuale principale fonte industriale del tiofene è la sintesi da butano e zolfo che porta a tiofene e solfuro di idrogeno.
Tiofeni esistenti in natura
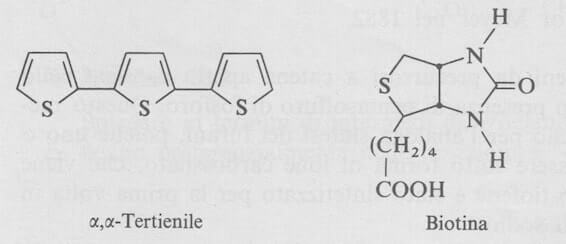
Pochi derivati tiofenici esistono in natura.
Una interessante eccezione è l'α,α-tertienile che si trova nei fiori di certe specie di calendule.
La biotina (un derivato ridotto del tiofene) è un importante coenzima che gioca un ruolo essenziale in alcune reazioni biochimiche di carbossilazione. Essa è coinvolta nella biosintesi degli acidi grassi a lunga catena partendo dall'acido acetico.
Usi del tiofene
L'importanza industriale del tiofene è limitata, mentre assai più utilizzati sono alcuni suoi derivati che trovano impiego nell'industria dei coloranti, dei detergenti e dei prodotti farmaceutici.
Link correlati:
Che cosa sono gli azoli?
Proprietà della tiazolo
Proprietà e caratteristiche della pirocatechina
Studia con noi