Furano
Proprietà e caratteristiche del furano
Il furano è un composto eterociclico di formula C4H4O.
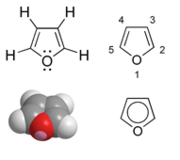
Ha massa molare di 68,07 g/mol e temperatura di ebollizione di 32°C.
È detto anche furfurano essendo stato isolato per la prima volta dalla crusca (in latino fur).
Il furano è dotato di caratteristiche aromatiche dovute alla delocalizzazione di sei elettroni, di cui due provenienti dall'orbitale di tipo p dell'atomo di ossigeno.
Il sistema di numerazione e le principali forme di risonanza del furano vengono qui indicate. Da esse è possibile notare che i carboni dell'anello aromatico del furano sono attivati rispetto ai reattivi elettrofili:
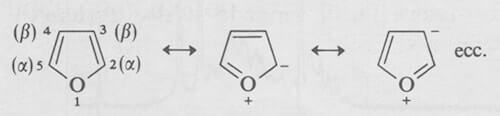
All'eteroatomo si assegna il numero 1, che è il più basso possibile. Il carbonio adiacente è il carbonio α, mentre quello più lontano è il carbonio ß.
Di seguito sono riportate le strutture del 2-furile (a sinistra) e del furfurile (a destra), importanti sostituenti organici derivati dal furano.
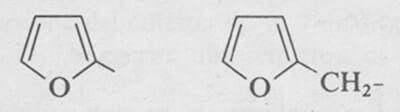
Gruppo 2-furile (a sinistra) e gruppo furfurile (a destra).
Proprietà chimiche del furano
L'energia di coniugazione del furano è soltanto di 16 kcal/mole, ed è quindi considerevolmente minore di quella del benzene (36 kcal/mole).
Questo è dovuto al fatto che il furano ha il suo sestetto di elettroni π delocalizzato solo parzialmente.
Di conseguenza il furano deve avere ed effettivamente ha delle proprietà chimiche intermedie tra quelle di un sistema altamente delocalizzato come il benzene e quelle di un semplice diene ciclico che sia anche un enoletere.
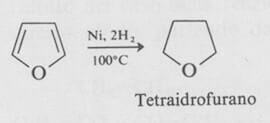
Per quanto riguarda la sua reattività, ricordiamo che il furano può essere ridotto cataliticamente per dare un etere saturo stabile, il tetraidrofurano (spesso abbreviato come THF), che è un solvente molto utile.
Il furano dà reazione di sostituzione elettrofila aromatica molto più facilmente del benzene; molte delle reazioni di questo tipo (ad esempio la clorurazione, la nitrazione, la solfonazione) non sono tuttavia di importanza pratica per le seguenti ragioni:
- il furano è molto sensibile agli acidi forti (ad esempio l'acido solforico concentrato provoca una polimerizzazione del furano immediata, vigorosa ed esotermica;
- anche a bassa temperatura può essere molto difficile controllare il numero dei sostituenti che entrano (ad esempio nella clorurazione);
- si può verificare una addizione 2,5 del reagente, invece di avere sostituzione.
La reazione elettrofila migliore e più facile da condurre è la acilazione di Friedel e Crafts, che deve essere effettuata in condizioni molto blande come è illustrato di seguito nella sintesi del 2-acetilfurano.
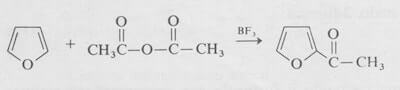
Da notare che la posizione α del furano è quella che viene attaccata più facilmente da un reattivo elettrofilo.
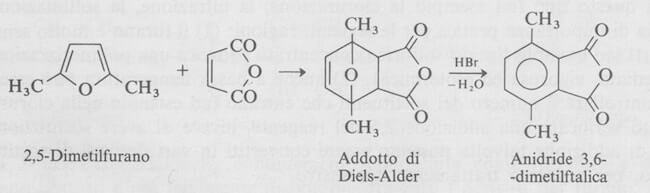
Una conseguenza interessante del basso grado di aromaticità del furano è la sua abilità di comportarsi come un diene nella reazione di Diels-Alder.
Questa reazione è generale per i furani che non hanno gruppi elettron-attrattori come (ad esempio -CHO e -COOH).
Gli addotti Diels-Alder del furano danno una disidratazione che porta a derivati benzenici per trattamento con acidi minerali come HBr.
Sintesi del furano e dei suoi derivati
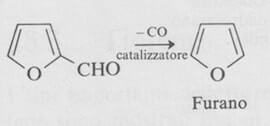
Il furano viene preparato industrialmente per decarbonilazione catalitica del furfurolo in vapore.
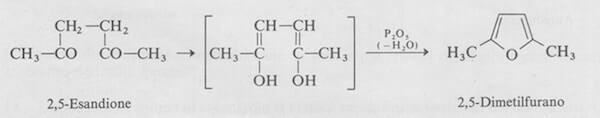
La sintesi più generale per i furani sostituiti è la disidratazione di un 1,4-dichetone mediante un reattivo acido come H2SO4 o P205.
Formalmente la reazione può essere considerata come una disidratazione della forma dienolica del dichetone, anche se in realtà il meccanismo della reazione è più complesso.
Studia con noi