Asparagina
Proprietà e caratteristiche dell'asparagina
L'asparagina è un amminoacido con catena laterale polare, essa è presente nelle proteine nella configurazione L.
Fu il primo amminoacido ad essere isolato.
Il suo nome IUPAC è 4-ammide dell'acido 2(S)-ammino-1,4-butandioico, ma è nota anche come acido L-2-amminosuccinamico, e viene indicata con le sigle Asn e N.
La sua formula bruta dè C4H8N2O3, pertanto essa ha una massa molare di 132,12 g/mol.
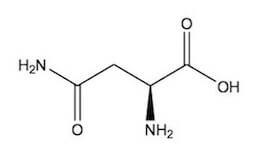
L-asparagina.
Essa è l'ammide dell'acido aspartico; il gruppo ammidico le conferisce una pkR (la costante di dissociazione acida della catena laterale) di 13,2; la sua pk1 (la costante di dissociazione acida del gruppo carbossilico) e la sua pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente 2,14 e 8,72. Ha un pI (punto isoelettrico) di 5,41.
L'asparagina si presenta come un solido cristallino bianco, ha una solubilità in acqua pari a 29,4 g/L a temperatura ambiente e la sua temperatura di fusione è 234 °C .
Proprietà dell'asparagina
L'asparagina è un amminoacido non essenziale, in quanto essa può essere prodotta dall'organismo.
Comunque, le principali fonti alimentari di questo amminoacido sono: uova, carne, latte, formaggi, yogurt, pesce, molluschi, asparagi (da cui prende il nome), patate, noci, semi e legumi.
L'odore tipico dell'urina delle persone in seguito al consumo di asparagi è attribuita al sottoprodotto della degradazione dell'asparagina, ma vi è un'altra teoria secondo la quale l'odore è causato da un'altra molecola, ossia l'acido asparagusico.
L'asparagina svolge diverse funzioni all'interno dell'organismo: è fondamentale per la produzione delle proteine, degli enzimi e del tessuto muscolare.
Supplementi di questo amminoacido sono richiesti per bilanciare la funzione del sistema nervoso, ma non è noto se elevate dosi di asparagina influenzino l'assorbimento di altri amminoacidi.
L'asparagina trasporta l'azoto nell'organismo, costituisce un importante supporto per la produzione energetica ed è importante per il tessuto nervoso, in particolare per lo sviluppo e la funzionalità del cervello.
Inoltre essa può aumentare, essendo un amminoacido glucagonogenico, la sintesi del glucagone, l'ormone antagonista dell'insulina, il quale determina un aumento della glicemia.
L'asparagina è stata utilizzata per alcune applicazioni cliniche quali il recupero dall'esercizio fisico intenso.
Infatti, questo amminoacido riduce la fatica secondo alcuni studi di laboratorio e sempre secondo recenti studi, un incremento di asparagina migliora la sensibilità all'insulina.
La carenza di un amminoacido non essenziale quale l'asparagina non si verifica in caso di dieta ben bilanciata.
Bassi livelli di asparagina possono indicare uno scarso metabolismo o una scarsa sintesi dell'acido aspartico, che può risultare nell'incapacità di sintetizzare ed espellere in maniera appropriata l'urea, che è il maggiore prodotto di scarto di una dieta ricca di proteine.
L'incapacità di espellere l'urea può determinare la formazione di metaboliti tossici contenenti azoto, che possono causare diversi sintomi, quali depressione, irritabilità, mal di testa, confusione o, in casi più estremi, psicosi.
L'asparagina è coinvolta nel controllo del metabolismo e delle funzioni cellulari nei nervi e nel tessuto cerebrale.
Poiché la catena laterale dell'asparagina è capace di formare in maniera efficiente legami a idrogeno con lo scheletro dei peptidi, i residui di asparagina si trovano spesso alla fine e all'inizio delle α-eliche e nei turn-motifs dei foglietti beta, che costituiscono la struttura secondaria delle proteine.
L'asparagina fornisce anche siti-chiave per l'N-glicosilazione, cioè la modificazione della catena proteica con l'aggiunta di catene di carboidrati.
Questo processo biochimico avviene in due fasi: inizialmente, nel reticolo endoplasmatico rugoso, durante la traduzione; quindi, le proteine glicosilate vengono trasportate nell'apparato di Golgi per mezzo di vescicole.
In particolare, nel Golgi le proteine subiscono reazioni dipendenti dalla loro funzione o dal loro destino.
In base al tipo di catena zuccherina, le proteine vengono indirizzate verso diversi siti: verso lisosomi o perossisomi, oppure alla membrana, dove possono svolgere il loro compito.
L'asparagina può subire diverse reazioni chimiche e formare l'acrilammide, un composto mutageno e cancerogeno, con tossicità sistemica, ma più nocivo per l'apparato riproduttivo e il sistema nervoso centrale e periferico (tra gli effetti di questa molecola, la polineuropatia).
Essa può essere prodotta in diversi modi, ma in genere si forma per l'interazione tra asparagina e zuccheri riducenti (come fruttosio e glucosio) o molecole contenenti gruppi carbonilici reattivi, a temperature superiori a 120°C, quindi l'acrilammide è tipica dei cibi cotti.
Questa sostanza è estremamente reattiva e, all'interno dell'organismo, interagisce con proteine e acidi nucleici, modificandone la struttura e impedendone il corretto funzionamento.
In passato uno dei farmaci impiegati nel trattamento di alcune forme tumorali era l'enzima asparaginasi, che catalizza la reazione di degradazione dell'asparagina, riducendone la concentrazione.
Questo si spiega col fatto che diverse cellule tumorali, in particolari quelle leucemiche, utilizzano l'asparagina per il loro metabolismo.
Quindi, il chemioterapico pegaspargasi (contenente asparaginasi) veniva impiegato in particolare per patologie quali il linfoma e la leucemia linfoblastica acuta.
Biochimica dell'asparagina
L'asparagina può essere sintetizzata dall'organismo, in particolare nel fegato, a partire dall'acido aspartico.
Quest'ultimo viene a sua volta sintetizzato a partire dall'ossalacetato, per transamminazione col glutammato.
Questa reazione reversibile è catalizzata dall'enzima aspartato amminotransferasi (o aspartato transaminasi o transaminasi glutammico-ossalacetica), che utilizza la vitamina B6 come cofattore e porta, quindi, alla formazione dell'aspartato e dell'α-chetoglutarato a partire da ossalacetato e glutammato.
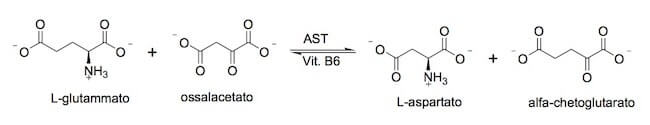
Reazione di transamminazione.
L'aspartato così ottenuto subisce reazione di ammidazione, catalizzata dall'asparagina sintetasi, reagendo con la glutammina, che funge da donatore di ammonio (NH4+).
Oltre all'asparagina si ottiene il glutammato.
L'enzima coinvolto in questa reazione utilizza ATP come fonte di energia.
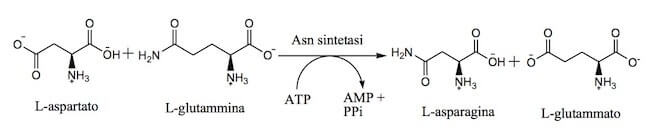
Reazione di ammidazione dell'aspartato.
L'asparagina può essere convertita in ossalacetato ed entrare così nel ciclo di Krebs, una tappa fondamentale del metabolismo energetico.
L'enzima asparaginasi catalizza la reazione di idrolisi dell'asparagina, che perde il gruppo ammidico per formare l'aspartato.
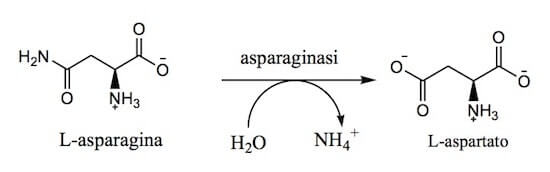
Reazione catalizzata dall'asparaginasi.
L'asparatato subisce, quindi, reazione di transamminazione, interagendo con l'α-chetoglutarato, per dare glutammato e ossalacetato.
Questa reazione di transamminazione, catalizzata dall'aspartato amminotransferasi è la reazione inversa di quella di formazione dell'aspartato, già vista in precedenza.
Durante la traduzione o sintesi proteica, l'amminoacido asparagina è codificato dalle triplette di nucleotidi AAT e AAC.
Studia con noi