NAD e NADH
NAD e NADH - nicotinammide adenina dinucleotide
Il NAD, nicotinammide adenina dinucleotide, è un coenzima in cui sono presenti due nucleotidi uniti mediante un legame fosfoanidridico tra i rispettivi gruppi fosfato.
Uno dei due nucleotidi è formato da ribosio e adenina, l'altro contiene ribosio e l'anello nicotinammidico.
Oltre al NAD le cellule utilizzano l'analogo nicotinammide adenina dinucleotide fosfato o NADP.
Il NAD è coinvolto nelle reazioni redox in cui vengono trasferiti ioni idruro (H−); esso può esistere in forma ossidata NAD+ o ridotta NADH.
La riduzione del NAD+ avviene sull'anello nicotinammidico dove l'atomo di azoto perde la carica positiva presente nella forma ossidata.
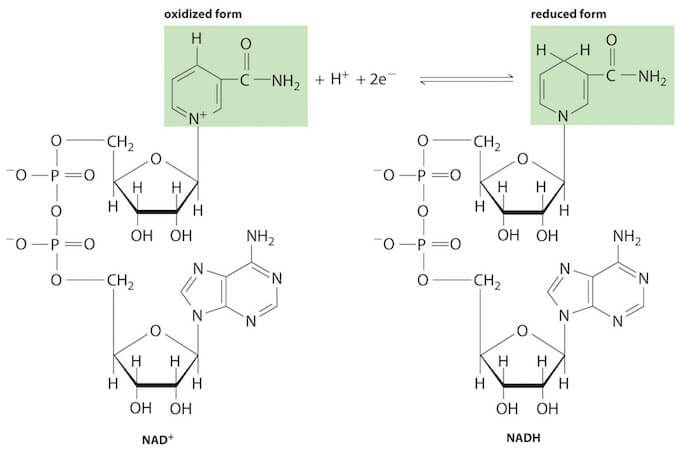
Il NAD contiene due nucleotidi tenuti insieme da un legame fosfoanidridico. La forma ossidata (NAD+) presenta una carica positiva sull'atomo di azoto dell'anello piridinico. In seguito a riduzione mediante uno ione idruro (H+ + 2e−) la carica positiva scompare.
Ruolo del NAD nella cellula
Il ruolo di un coenzima è quello di coadiuvare l'attività catalitica di un enzima, legandosi ad esso in modo transitorio o permanente.
Quando un coenzima è legato stabilmente in modo covalente al proprio enzima è definito gruppo prostetico.
Il NAD interagisce con gli enzimi in modo relativamente debole e diffonde facilmente dalla superficie di un enzima a quella di un altro.
Il NAD interviene nelle reazioni di ossidoriduzione catalizzate da enzimi chiamati in modo generico ossidoreduttasi e più comunemente come deidrogenasi (talvolta reduttasi), dato che il trasferimento di elettroni da un substrato a un altro avviene mediante ioni idruro (H−), cioè atomi di idrogeno carichi negativamente per la presenza di un elettrone in più, oltre a quello normalmente presente.
Gli ioni idruro consentono quindi di ossidare o ridurre le molecole mediante il trasferimento di due elettroni per volta.
Le reazioni redox in cui sono coinvolti NAD prevedono anche il trasferimento di ioni idrogeno (H+) dal mezzo acquoso al substrato o viceversa.
Tipicamente associati alla regolazione del metabolismo energetico, nuove evidenze sperimentali hanno dimostrato il coinvolgimento del NAD (e del NADP) anche in altri processi di cruciale importanza: omeostasi del calcio, sistemi antiossidanti, espressione genica, funzioni immunitarie, invecchiamento e morte cellulare.
Enzimi che utilizzano NAD
Sono noti più di 200 enzimi che catalizzano reazioni in cui il NAD+ accetta uno ione idruro da un composto ridotto oppure in cui il NADH cede uno ione idruro per ridurre un composto.
Sebbene NAD e NADP operino in modo analogo, differiscono per il tipo di enzimi a cui si legano e di substrati di cui promuovono l'ossidazione o la riduzione.
Anche i rapporti in termini di concentrazione, NAD+/NADH e NADP+/NADPH, sono diversi nella cellula.
La concentrazione di NAD+ è notevolmente più alta rispetto alla forma ridotta, contrariamente a quanto succede per la coppia NADP+/NADPH.
Precise vie metaboliche consentono di rigenerare continuamente il NAD+.
La riossidazione del NADH a NAD+ avviene in massima parte attraverso la fosforilazione ossidativa in condizioni aerobiche, alternativamente attraverso la fermentazione lattica e la fermentazione alcolica, a seconda del tipo di organismo.
La riduzione del NADP+ a NADPH è affidata alla via dei pentoso fosfati.
Queste differenze tra NAD e NADP ne riflettono il diverso ruolo nel metabolismo energetico: NAD+ è preferibilmente coinvolto nei processi ossidativi delle reazioni cataboliche, mentre il NADPH interviene nelle biosintesi riduttive dell'anabolismo (ad esempio nella biosintesi degli acidi grassi).
In questo modo catabolismo e anabolismo sono adeguatamente diversificati e regolati in modo autonomo.
Lo schema generico delle reazioni redox in cui interviene NAD:
AH2 + NAD+ → A + NADH + H+ [Ossidazione di un substrato]
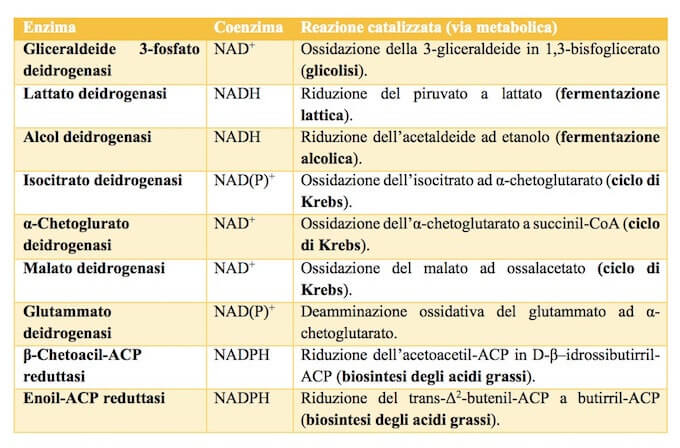
La tabella riporta alcuni dei principali enzimi che utilizzano NAD (o NADP) o entrambi nella cellula.
La nicotinnamide deriva dalla vitamina B3
L'anello nicotinammidico deriva dalla niacina (acido nicotinico) o vitamina B3.
La derivazione da una delle vitamine idrosolubili del gruppo B è comune a moli altri coenzimi, come al FAD.
L'acido nicotinico a sua volta è sintetizzato a partire dall'aminoacido triptofano.
In laboratorio l'acido nicotinico è stato ottenuto per la prima volta dall'ossidazione della nicotina, da cui prende il nome.
Tuttavia, la nicotina assunta ad esempio con le sigarette non è utilizzabile dal nostro organismo.
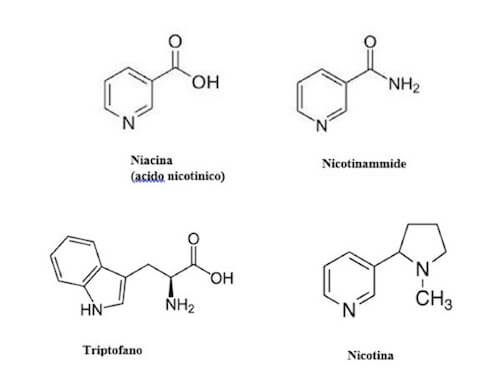
Le strutture chimiche di niacina, nicotinammide, triptofano e nicotina.
L'organismo umano è in grado di sintetizzare la niacina dal triptofano oppure di assumerla direttamente da alcuni alimenti.
Il termine acido nicotinico deriva dalla nicotina dalla cui ossidazione è stato per la prima volta ottenuto in laboratorio.
L'uomo è in grado di sintetizzare la quantità di niacina necessaria al suo fabbisogno se l'assunzione di triptofano con la dieta è adeguata.
Molti alimenti sono comunque già ricchi di vitamina B3, come carni, legumi, riso integrale, orzo, vegetali a foglia verde, vari semi e frutti.
La carenza di niacina causa nell'uomo una grave malattia, la pellagra (pelle rugosa), e nei cani una patologia con caratteristiche simili, la lingua nera.
I sintomi di queste patologie sono le cosiddette 3 D: demenza, dermatite e diarrea, seguite spesso dalla morte.
La niacina è anche nota come vitamina PP (preventing pellagra), proprio per la capacità di prevenire e curare la pellagra.
La pellagra è ancora presente tra le popolazioni più povere di alcuni paesi e, nel mondo sviluppato, si manifesta tra gli alcolisti, che soddisfano il loro bisogno calorico con l'alcol e la loro alimentazione è carente di molti nutrienti essenziali tra cui le vitamine e appunto la niacina.
Link correlti:
Che cos'è l'alcol deidrogenasi?
Studia con noi